1 范围
本标准规定了食品中单核细胞增生李斯特氏菌(Listeria monocytogenes)的检验方法。
本标准适用于食品中单核细胞增生李斯特氏菌的检验。
2 设备和材料
除微生物实验室常规无菌及培养设备外,其他设备和材料如下:
2.1 冰箱:2 ℃~5 ℃。
2.2 恒温培养箱:30 ℃±1 ℃、36 ℃±1 ℃。
2.3 均质器。
2.4 显微镜:10×~100×。
2.5 电子天平:感量 0.1 g 。
2.6 锥形瓶:100 mL、500 mL。
2.7 无菌吸管:1 mL(具 0.01 mL 刻度)、10 mL(具 0.1 mL 刻度)。
2.8 无菌平皿:直径 90 mm。
2.9 无菌试管:16 mm×160 mm.。
2.10 离心管:30 mm×100 mm。
2.11 无菌注射器:1 mL。
2.12 金黄色葡萄球菌(ATCC25923)。
2.13 马红球菌(Rhodococcus equi)。
2.14 小白鼠:16 g~18 g。
2.15 全自动微生物生化鉴定系统。
3 培养基和试剂
3.1 含 0.6 %酵母浸膏的胰酪胨大豆肉汤(TSB-YE):见附录 A 中 A.1。
3.2 含 0.6 %酵母浸膏的胰酪胨大豆琼脂(TSA-YE):见附录 A 中 A.2。
3.3 李氏增菌肉汤 LB(LB 1,LB 2):见附录 A 中 A.3。
3.4 1 %盐酸吖啶黄(acriflavine HCl)溶液:见附录 A 中 A.3.2.1。
3.5 1 %萘啶酮酸钠盐(naladixic acid)溶液:见附录 A 中 A.3.2.1。
3.6 PALCAM 琼脂:见附录 A 中 A.4。
3.7 革兰氏染液:见附录 A 中 A.5。
3.8 SIM 动力培养基:见附录 A 中 A.6。
3.9 缓冲葡萄糖蛋白胨水[甲基红(MR)和 V-P 试验用]:见附录 A 中 A.7。
3.10 5 %~8 %羊血琼脂:见附录 A 中 A.8。
3.11 糖发酵管:见附录 A 中 A.9。
3.12 过氧化氢酶试验:见附录 A 中 A.10。
3.13 李斯特氏菌显色培养基。
3.14 生化鉴定试剂盒。
4. 检验程序
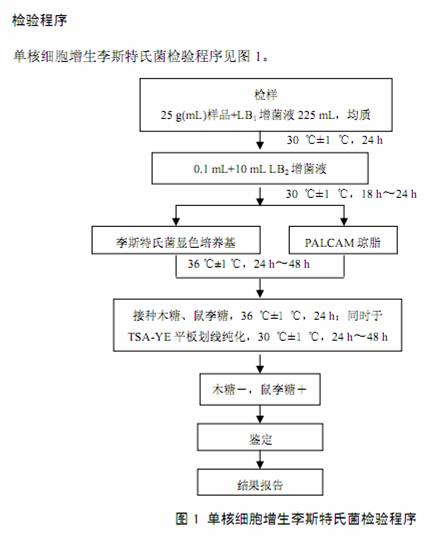
单核细胞增生李斯特氏菌检验程序见图 1。
5 操作步骤
5.1 增菌
以无菌操作取样品 25 g(mL)加入到含有 225 mL LB 1 增菌液的均质袋中,在拍击式均质器上连续均质 1 min~2 min;或放入盛有 225 mL LB 1 增菌液的均质杯中,8000 r/min~10000 r/min 均质 1 min~2 min。于 30 ℃±1 ℃培养 24 h,移取 0.1 mL,转种于 10 mL LB 2 增菌液内,于30℃±1 ℃培养 18 h~24 h。
5.2 分离
取 LB 2 二次增菌液划线接种于 PALCAM 琼脂平板和李斯特氏菌显色培养基上,于 36℃±1℃培养 24 h~48 h,观察各个平板上生长的菌落。典型菌落在 PALCAM 琼脂平板上为小的圆形灰绿色菌落,周围有棕黑色水解圈,有些菌落有黑色凹陷;典型菌落在李斯特氏菌显色培养基上的特征按照产品说明进行判定。
5.3 初筛
自选择性琼脂平板上分别挑取 5 个以上典型或可疑菌落,分别接种在木糖、鼠李糖发酵管,于 36℃±1℃培养 24 h;同时在 TSA-YE 平板上划线纯化,于 30℃±1 ℃培养 24 h~48 h。选择木糖阴性、鼠李糖阳性的纯培养物继续进行鉴定。
5.4 鉴定
5.4.1 染色镜检:李斯特氏菌为革兰氏阳性短杆菌,大小为(0.4m~0.5m)×(0.5m~2.0m);
用生理盐水制成菌悬液,在油镜或相差显微镜下观察,该菌出现轻微旋转或翻滚样的运动。
5.4.2 动力试验:李斯特氏菌有动力,呈伞状生长或月牙状生长。
5.4.3 生化鉴定:挑取纯培养的单个可疑菌落,进行过氧化氢酶试验,过氧化氢酶阳性反应的菌落继续进行糖发酵试验和 MR-VP 试验。单核细胞增生李斯特氏菌的主要生化特征见表 1。
5.4.4 溶血试验:将羊血琼脂平板底面划分为 20 个~25 个小格,挑取纯培养的单个可疑菌落刺种到血平板上,每格刺种一个菌落,并刺种阳性对照菌(单增李斯特氏菌和伊氏李斯特氏菌)和阴性对照菌(英诺克李斯特氏菌),穿刺时尽量接近底部,但不要触到底面,同时避免琼脂破裂,36 ℃±1 ℃培养 24 h~48 h,于明亮处观察,单增李斯特氏菌和斯氏李斯特氏菌在刺种点周围产生狭小的透明溶血环,英诺克李斯特氏菌无溶血环,伊氏李斯特氏菌产生大的透明溶血环。
5.4.5 协同溶血试验 (cAMP):在羊血琼脂平板上平行划线接种金黄色葡萄球菌和马红球菌, 挑取纯培养的单个可疑菌落垂直划线接种于平行线之间,垂直线两端不要触及平行线,于 30 ℃±1 ℃培养 24 h~48 h。单核细胞增生李斯特氏菌在靠近金黄色葡萄球菌的接种端溶血增强,斯氏李斯特氏菌的溶血也增强,而伊氏李斯特氏菌在靠近马红球菌的接种端溶血增强。
5.5 可选择生化鉴定试剂盒或全自动微生物生化鉴定系统等对 5.3 中 3个~5个纯培养的可疑菌落进行鉴定。
|

