

 海博微信公众号
海博微信公众号
 海博天猫旗舰店
海博天猫旗舰店


 海博微信公众号
海博微信公众号
 海博天猫旗舰店
海博天猫旗舰店




1 范围
本标准规定了食品中致泻大肠埃希氏菌(diarrheagenic Escherichia coli)的检验方法。
本标准适用于食品中致泻大肠埃希氏菌的检验。
2 术语和定义、缩略语
2.1 术语和定义
下列术语和定义适用于本文件。
2.1.1 致泻大肠埃希氏菌 Diarrheagenic Escherichia coli
一类能引起人体以腹泻症状为主的大肠埃希氏菌,可经过污染食物引起人类发病。常见的致泻大肠埃希氏菌主要包括肠道致病性大肠埃希氏菌、肠道侵袭性大肠埃希氏菌、产肠毒素大肠埃希氏菌、产志贺毒素大肠埃希氏菌(包括肠道出血性大肠埃希氏菌)和肠道集聚性大肠埃希氏菌。
2.1.2 肠道致病性大肠埃希氏菌 Enteropathogenic Escherichia coli
能够引起宿主肠粘膜上皮细胞黏附及擦拭性损伤,且不产生志贺毒素的大肠埃希氏菌。它是发展中国家婴幼儿腹泻的主要病原菌,有高度传染性,严重者可致死。EPEC的致病机制包括局限性粘附、信号传导和紧密粘附。其中,局限性粘附由存在于EAF质粒上的束状菌毛基因bfp介导,位于LEE毒力岛上的III型分泌系统编码基因esc参与信号传导,引起微绒毛结构消失;而紧密粘附由外膜蛋白紧密素介导,紧密素由eae基因编码。
2.1.3 肠道侵袭性大肠埃希氏菌 Enteroinvasive Escherichia coli
能够侵入肠道上皮细胞而引起痢疾样腹泻的大肠埃希氏菌。该菌不像典型的大肠埃希氏菌,无动力、不发生赖氨酸脱羧反应、不发酵乳糖,生化反应和抗原结构均近似痢疾志贺氏菌。侵入上皮细胞的关键基因是侵袭性质粒上的抗原编码基因及其调控基因,如ipaH基因、ipaR基因(又称为invE基因)。
2.1.4 产肠毒素大肠埃希氏菌 Enterotoxigenic Escherichia coli
能够分泌热稳定性肠毒素或/和热不稳定性肠毒素的大肠埃希氏菌。热稳定性肠毒素按照来源不同分为猪源热稳定性肠毒素和人源热稳定性肠毒素,编码基因分别为stp(又称为stIa)和sth(又称为stIb);热不稳定性肠毒素编码基因为lt。两种肠毒素基因在产肠毒素大肠埃希氏菌中可以单独存在,也可以同时存在。该菌可引起婴幼儿和旅游者腹泻,一般呈轻度水样腹泻,也可呈严重的霍乱样症状,低热或不发热。腹泻常为自限性,一般2~3天即自愈。
2.1.5 产志贺毒素大肠埃希氏菌 Shiga toxin-producing Escherichia coli(肠道出血性大肠埃希氏菌 Enterohemorrhagic Escherichia coli)
能够分泌志贺毒素、引起宿主肠粘膜上皮细胞黏附及擦拭性损伤的大肠埃希氏菌。志贺毒素的编码基因为stx,志贺毒素分为两种类型,其编码基因分别为stx1和stx2,相互间无免疫交叉反应。stx1和stx2 在产志贺毒素大肠埃希氏菌中可以单独存在,也可以同时存在。宿主肠粘膜上皮细胞黏附及擦拭性损伤表现为微绒毛结构消失和紧密粘附,分别由esc编码的III型分泌系统和eae编码的紧密素介导。另外,有些产志贺毒素大肠埃希氏菌在临床上引起人类出血性结肠炎(HC)或血性腹泻,并可进一步发展为溶血性尿毒综合征(HUS),这类产志贺毒素大肠埃希氏菌为肠道出血性大肠埃希氏菌。
2.1.6 肠道集聚性大肠埃希氏菌 Enteroaggregative Escherichia coli
肠道集聚性大肠埃希氏菌不侵入肠道上皮细胞,但能引起肠道液体蓄积。不产生热稳定性肠毒素或热不稳定性肠毒素,也不产生志贺毒素。唯一特征是能对Hep-2细胞形成集聚性粘附,也称Hep-2细胞粘附性大肠埃希氏菌。
2.2 缩略语
下列缩略语适用于本文件。
2.2.1 DEC:致泻大肠埃希氏菌 Diarrheagenic Escherichia coli
2.2.2 EPEC:肠道致病性大肠埃希氏菌 Enteropathogenic Escherichia coli
2.2.3 EIEC:肠道侵袭性大肠埃希氏菌 Enteroinvasive Escherichia coli
2.2.4 ETEC:产肠毒素大肠埃希氏菌 Enterotoxigenic Escherichia coli
2.2.5 STEC:产志贺毒素大肠埃希氏菌 Shiga toxin-producing Escherichia coli
2.2.6 EHEC:肠道出血性大肠埃希氏菌 Enterohemorrhagic Escherichia coli
2.2.7 EAEC:肠道集聚性大肠埃希氏菌 Enteroaggregative Escherichia coli
2.2.8 escV:蛋白分泌物调节基因,gene encoding LEE-encoded type III secretion system factor
2.2.9 eae:紧密素基因,gene encoding intimin for Escherichia coli attaching and effacing
2.2.10 bfpB:束状菌毛B基因,bundle-forming pilus B;
2.2.11 stx1:志贺毒素Ⅰ基因,Shiga toxin one
2.2.12 stx2:志贺毒素Ⅱ基因,Shiga toxin two
2.2.13 lt:热不稳定性肠毒素基因,heat-labile enterotoxin
2.2.14 st:热稳定性肠毒素基因,heat-stable enterotoxin
2.2.15 stp(stIa):猪源热稳定性肠毒素基因,heat-stable enterotoxins initially discovered in the isolates from pigs
2.2.16 sth(stIb):人源热稳定性肠毒素基因,heat-stable enterotoxins initially discovered in the isolates from human
2.2.17 invE:侵袭性质粒调节基因,invasive plasmid regulator;
2.2.18 ipaH:侵袭性质粒抗原H基因,invasive plasmid antigen H-gene;
2.2.19 aggR:集聚粘附菌毛调节基因,aggregative adhesive fimbriae regulator;
2.2.20 uidA:β-葡萄糖苷酶基因,β-glucuronidase gene;
2.2.21 astA:集聚热稳定性毒素A基因,enteroaggregative heat-stable enterotoxin A;
2.2.22 pic:肠定植因子基因,protein involved in intestinal colonization;
2.2.23 LEE:肠细胞损伤基因座,Locus of enterocyte effacement
2.2.24 EAF:EPEC黏附因子,EPEC adhesive factor
3 设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:
a)恒温培养箱: 36 ℃±1 ℃,42 ℃±1 ℃;
b)冰箱:2 ℃~5 ℃;
c)恒温水浴箱:100℃,50℃±1 ℃;
d) 电子天平:感量0.1 g,感量0.01 g;
e)显微镜:10倍~100倍;
f)均质器;
g)振荡器;
h)无菌吸管:1 mL(具0.01 mL刻度),10 mL(具0.1 mL刻度)或微量移液器及吸头;
i)无菌均质杯或无菌均质袋:容量 500 mL;
j)无菌培养皿:直径90 mm;
k)pH计或精密pH试纸;
l)微量离心管:1.5 mL/2.0 mL;
m)低温高速离心机;
n)全自动微生物生化鉴定系统;
o)PCR仪;
p)水平电泳仪;
q)8联排管和8联排盖(平盖/凸盖);
r)凝胶成像仪。
4 培养基和试剂
4.1 营养肉汤:见附录A 中A.1。
4.2 肠道菌增菌肉汤:见附录A 中A.2。
4.3 麦康凯琼脂(MAC):见附录A 中A.3。
4.4伊红美蓝琼脂(EMB):见附录A 中A.4。
4.5 三糖铁(TSI)琼脂:见附录A 中A.5。
4.6 蛋白胨水、靛基质试剂:见附录A 中A.6。
4.7 半固体琼脂:见附录 A 中 A.7。
4.8 尿素琼脂(pH 7.2):见附录 A 中 A.8。
4.9 氰化钾 (KCN) 培养基:见附录 A 中 A.9。
4.10 氧化酶试剂:见附录 A 中 A.10。
4.11 革兰氏染色液:见附录A中A.11。
4.12 BHI肉汤:见附录A中A.12。
4.13 福尔马林(含38%~40%甲醛)。
4.14 生化鉴定试剂盒。
4.15 致泻大肠埃希氏菌PCR试剂盒。
4.16 大肠埃希氏菌诊断血清。
5 检验程序
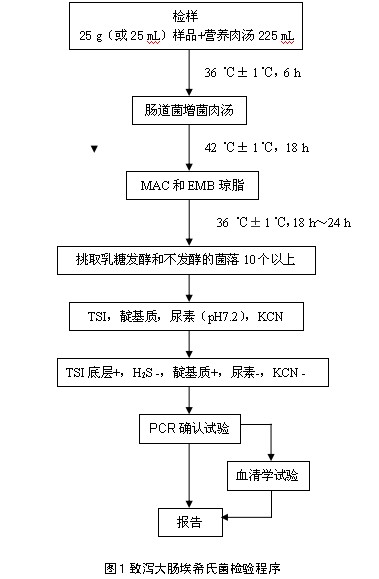
致泻大肠埃希氏菌检验程序见图1。
6 操作步骤
6.1增菌
以无菌操作取检样25 g(或25 mL),加入装有灭菌225 mL营养肉汤的均质杯中,用旋转刀片式均质器以8 000 r/min~10 000 r/min均质1 min~2 min;或加入装有225 mL营养肉汤的均质袋中,用拍击式均质器均质1 min~2 min。液体样品振荡混匀即可。于36 ℃±1℃培养6 h。取10 μL,接种于30 mL肠道菌增菌肉汤管内,于42 ℃±1℃培养18 h。
6.2 分离
将增菌液划线接种MAC和EMB琼脂平板,于36 ℃ ± 1 ℃培养18 h~24 h,观察菌落特征。在MAC琼脂平板上,分解乳糖的典型菌落为砖红色,不分解乳糖的菌落为无色或淡粉色;在EMB琼脂平板上,分解乳糖的典型菌落为中心紫黑色带或不带金属光泽,不分解乳糖的菌落为无色或淡粉色。不但要挑取乳糖发酵的菌落,同时也要挑取乳糖不发酵和迟缓发酵的菌落。
6.3 生化试验
6.3.1 选取平板上可疑菌落10个~20个(10个以下全选),分别接种TSI。同时将这些培养物分别接种蛋白胨水、尿素琼脂(pH 7.2)和KCN肉汤。于36 ℃±1 ℃培养18 h~24 h。
6.3.2 TSI斜面产酸或不产酸,底层产酸,靛基质阳性,H2S阴性和尿素酶阴性的培养物为大肠埃希氏菌。TSI底层不产酸,或H2S、KCN、尿素有任一项为阳性的培养物,均非大肠埃希氏菌。必要时做革兰氏染色和氧化酶试验。大肠埃希氏菌为革兰氏阴性杆菌,氧化酶阴性。
6.3.3 如选择生化鉴定试剂盒或全自动微生物生化鉴定系统,可从营养琼脂平板上挑取可疑菌落用0.85%灭菌生理盐水制备成浊度适当的菌悬液,使用生化鉴定试剂盒或全自动微生物生化鉴定系统进行鉴定。
6.4 PCR确认试验
6.4.1 取生化反应符合大肠埃希氏菌特征的菌落进行PCR确认试验。
6.4.2 使用1 μL取菌环刮取营养琼脂平板或斜面上培养18 h~24 h的菌落,悬浮在200 μL0.85%灭菌生理盐水中,充分打散制成菌悬液,于13000 rpm离心3 min,弃掉上清液。加入1mL灭菌去离子水充分混匀菌体,于100 °C水浴或者金属浴维持10 min;冰浴冷却后,13000 rpm离心3 min,收集上清液;按1:10的比例用灭菌去离子水稀释上清液,取2 µL作为PCR检测的模板;所有处理后的DNA模板在-20°C以下保存备用。也可用细菌基因组提取试剂盒提取基因组DNA,操作方法按照细菌基因组提取试剂盒说明书进行。
6.4.3 每次PCR反应使用EPEC、EIEC、STEC/ETEC、EHEC、EAEC标准菌株作为阳性对照。同时,使用大肠埃希氏菌ATCC 25922阴性对照控制PCR体系污染。致泻大肠埃希氏菌特征性基因见表1。
表1 五种致泻大肠埃希氏菌特征基因
|
致泻大肠埃希氏菌类别 |
特征性基因 |
|
|
EPEC |
escV或eae、bfpB |
uidA |
|
STEC/EHEC |
escV或eae、stx1、stx2 |
|
|
EIEC |
invE或ipaH |
|
|
ETEC |
lt、stp、sth |
|
|
EAEC |
astA、aggR、pic |
|
6.4.4 聚合酶链反应(PCR)方法鉴定五种致泻大肠埃希氏菌的操作可参考附录B。
6.4.5 如用商品化PCR试剂盒或多重聚合酶链反应(MPCR)试剂盒,应按照PCR试剂盒说明书进行操作和结果判定。
6.5 血清学试验(选做项目)
注:应按照生产商提供的使用说明进行O抗原和H抗原的鉴定。当生产商的使用说明与下面的描述可能有偏差时,按生产商提供的使用说明进行。
6.5.1 取PCR试验确认为致泻大肠埃希氏菌的菌株进行血清学试验。
6.5.2 O抗原鉴定
6.5.2.1假定试验:挑取经生化试验和PCR试验证实为致泻大肠埃希氏菌的营养琼脂平板上的菌落,根据致泻大肠埃希氏菌的类别,选用大肠埃希氏菌单价或多价OK血清做玻片凝集试验。当与某一种多价OK血清凝集时,再与该多价血清所包含的单价OK血清做凝集试验。致泻大肠埃希氏菌所包括的O抗原群见表2。如与某一单价OK血清呈现凝集反应,即为假定试验阳性。
6.5.2.2证实试验:用0.85%灭菌生理盐水制备O抗原悬液,稀释至与Mac Farland 3号比浊管相当的浓度。原效价为1:160~1:320的O血清,用0.5%盐水稀释至1:40。将稀释血清与抗原悬液于10 mm×75 mm试管内等量混合,做单管凝集试验。混匀后放于50 ℃±1 ℃水浴箱内,经16 h后观察结果。如出现凝集,可证实为该O抗原。
表2 致泻大肠埃希氏菌主要的O抗原
|
DEC类别 |
DEC主要的O抗原 |
|
EPEC |
O26 O55 O86 O111ab O114 O119 O125ac O127 O128ab O142 O158等 |
|
STEC/EHEC |
O4 O26 O45 O91 O103 O104 O111 O113 O121 O128 O157 等 |
|
EIEC |
O28ac O29 O112ac O115 O124 O135 O136 O143 O144 O152 O164 O167等 |
|
ETEC |
O6 O11 O15 O20 O25 O27 O63 O78 O85 O114 O115 O26 O128ac O148 O149 O159 O166 O167等 |
|
EAEC |
O9 O62 O73 O101 O134等 |
6.5.3 H 抗原鉴定
6.5.3.1 取菌株穿刺接种半固体琼脂管,36 ℃ ± 1 ℃培养18 h~24 h,取顶部培养物1环接种至BHI 液体培养基中,于36 ℃ ± 1 ℃培养18 h~24 h。加入福尔马林至终浓度为0.5%,做玻片凝集或试管凝集试验。
6.5.3.2 若待测抗原与血清均无明显凝集,应从首次穿刺培养管中挑取培养物,再进行2~3次半固体管穿刺培养,按照6.5.3.1进行试验。
6.6 结果报告
6.6.1根据生化试验、PCR确认试验的结果,报告25 g(或mL)样品中检出或未检出某类致泻大肠埃希氏菌。
6.6.2如果进行血清学试验,根据血清学试验的结果,报告25 g(或mL)样品中检出的某类致泻大肠埃希氏菌血清型别。
附录A
培养基和试剂
A.1 营养肉汤
A.1.1 成分
|
蛋白胨 |
10.0g |
|
牛肉膏 |
3.0g |
|
氯化钠 |
5.0g |
|
蒸馏水 |
1000mL |
|
pH7.4±0.2 |
|
A.1.2 制法
将以上成分混合加热溶解,冷却至25 ℃左右校正pH至7.4±0.2,分装适当的容器。121 °C 灭菌15 min。
A.1 肠道菌增菌肉汤
A.1.1 成分
|
蛋白胨 |
10.0g |
|
葡萄糖 |
5.0g |
|
牛胆盐 |
20.0g |
|
磷酸氢二钠 |
8.0g |
|
磷酸二氢钾 |
2.0g |
|
煌绿 |
0.015g |
|
蒸馏水 |
1000mL |
|
pH7.2±0.2 |
|
A.1.2 制法
将以上成分混合加热溶解,冷却至25 ℃左右校正pH至7.2±0.2,分装每瓶30 mL。115 °C 灭菌20 min。
A.3 麦康凯琼脂(MAC)
A.3.1 成分
|
蛋白胨 |
20.0g |
|
乳糖 |
10.0g |
|
3号胆盐 |
1.5g |
|
氯化钠 |
5.0g |
|
中性红 |
0.03g |
|
结晶紫 |
0.001g |
|
琼脂 |
15.0g |
|
蒸馏水 |
1000mL |
pH7.2±0.2
A.3.2 制法
将以上成分混合加热溶解,冷却至25 ℃左右校正pH至7.2±0.2,分装。121℃高压灭菌15min。冷却至45 ℃~50 ℃,倾注平板。
注:如不立即使用,在2 ℃~8 ℃条件下可储存二周。
A.4 伊红美蓝(EMB)琼脂
A.4.1 成分
|
蛋白胨 |
10.0g |
|
乳糖 |
10.0 g |
|
磷酸氢二钾(K2HPO4) |
2.0g |
|
琼脂 |
15.0g |
|
2%伊红Y水溶液 |
20.0mL |
|
0.5%美蓝水溶液 |
13.0mL |
|
蒸馏水 |
1000mL |
pH7.1±0.2
A.4.2 制法
在1 000 mL蒸馏水中煮沸溶解蛋白胨、磷酸盐和乳糖,加水补足,冷却至25 ℃左右校正pH至7.1±0.2。再加入琼脂, 121 ℃高压灭菌15 min。冷至45 ℃~50 ℃,加入2%伊红Y水溶液和0.5%美蓝水溶液,摇匀,倾注平皿。
A.5 三糖铁琼脂(TSI)
A.5.1 成分
|
蛋白胨 |
20.0 g |
|
牛肉浸膏 |
5.0 g |
|
乳糖 |
10.0g |
|
蔗糖 |
10.0 g |
|
葡萄糖 |
1.0 g |
|
硫酸亚铁铵[(NH4)2Fe(SO4)2·6H2O] |
0.2 g |
|
氯化钠 |
5.0g |
|
硫代硫酸钠 |
0.2g |
|
酚红 |
0.025 g |
|
琼脂 |
12.0 g |
|
蒸馏水 |
1000mL |
pH 7.4±0.2
A.5.2 制法
除酚红和琼脂外,将其它成分加于400 mL水中,搅拌均匀,静置约10 min,加热使完全溶化, 冷却至25 ℃左右校正pH至 7.4±0.2。另将琼脂加于600 mL水中,静置约10 min,加热使完全溶化。将两溶液混合均匀,加入5%酚红水溶液5 mL,混匀,分装小号试管,每管约3 mL。于121 °C 灭菌15 min,制成高层斜面。冷却后呈桔红色。如不立即使用,在2 ℃ ~8 ℃条件下可储存一个月。
A.6 蛋白胨水、靛基质试剂
A.6.1 成分
|
胰蛋白胨 |
20.0 g |
|
氯化钠 |
5.0 g |
|
蒸馏水 |
1000mL |
pH 7.4±0.2
A.6.2 制法
将以上成分混合加热溶解,冷却至25 ℃左右校正pH至7.4±0.2,分装小试管,121 ℃高压灭菌 15 min。
注:此试剂在 2 ℃~8 ℃条件下可储存一个月。
A.6.3 靛基质试剂
A.6.3.1 柯凡克试剂:将 5 g 对二甲氨基苯甲醛溶解于 75 mL 戊醇中。然后缓慢加入浓盐酸 25 mL。
A.6.3.2 欧-波试剂:将 1 g 对二甲氨基苯甲醛溶解于 95 mL 95%乙醇内。然后缓慢加入浓盐酸 20 mL。
A.6.4 试验方法
挑取少量培养物接种,在36 ℃±1 ℃培养1 d~2 d,必要时可培养4 d~5 d。加入柯凡克试剂约0.5 mL,轻摇试管,阳性者于试剂层呈深红色;或加入欧-波试剂约 0.5 mL,沿管壁流下,覆盖于培养液表面,阳性者于液面接触处呈玫瑰红色。
A.7 半固体琼脂
A.7.1 成分
|
蛋白胨 |
1.0 g |
|
牛肉膏 |
0.3 g |
|
氯化钠 |
0.5 g |
|
琼脂 |
0.3g~0.5g |
|
蒸馏水 |
100.0mL |
pH 7.4±0.2
A.7.2 制法
按以上成分配好,加热溶解,冷却至25 ℃左右校正pH至 7.4 ± 0.2,分装小试管。121 ℃灭菌 15 min,直立凝固备用。
A.8 尿素琼脂(pH 7.2)
A.8.1 成分
|
蛋白胨 |
1.0 g |
|
氯化钠 |
5.0 g |
|
葡萄糖 |
1.0 g |
|
磷酸二氢钾 |
2.0 g |
|
0.4%酚红 |
3.0 mL |
|
琼脂 |
20.0 g |
|
20%尿素溶液 |
100.0 mL |
|
蒸馏水 |
1 000 mL |
pH7.2±0.2
A.8.2 制法
除酚红和尿素外的其他成分加热溶解,冷却至25 ℃左右校正pH至7.2±0.2,加入酚红指示剂,混匀,于121 ℃灭菌15 min。冷至约55 ℃,加入用0.22 µm过滤膜除菌后的20%尿素水溶液100 mL,混匀,以无菌操作分装灭菌试管,每管约3 mL~4 mL,制成斜面后放冰箱备用。
A.8.3 试验方法
挑取琼脂培养物接种,在 36 ℃±1 ℃培养 24 h,观察结果。尿素酶阳性者由于产碱而使培养基变为红色。
A.9 氰化钾(KCN)培养基
A.9.1 成分
|
蛋白胨 |
10.0 g |
|
氯化钠 |
5.0 g |
|
磷酸二氢钾 |
0.225 g |
|
磷酸氢二钠 |
5.64 g |
|
0.5%氰化钾 |
20.0 mL |
|
蒸馏水 |
1 000 mL |
A.9.2 制法
将除氰化钾以外的成分加入蒸馏水中,煮沸溶解,分装后 121 ℃高压灭菌 15 min。放在冰箱内使其充分冷却。每 100 mL 培养基加入 0.5%氰化钾溶液 2.0 mL(最后浓度为 1:10 000),分装于无菌试管内,每管约 4 mL,立刻用无菌橡皮塞塞紧,放在 4 ℃冰箱内,至少可保存两个月。同时,将不加氰化钾的培养基作为对照培养基,分装试管备用。
A.9.3 试验方法
将琼脂培养物接种于蛋白胨水内成为稀释菌液,挑取 1 环接种于氰化钾(KCN)培养基。并另挑取 1 环接种于对照培养基。在 36 ℃±1 ℃培养 1 d~2 d,观察结果。如有细菌生长即为阳性(不抑制),经 2 d 细菌不生长为阴性(抑制)。
注:氰化钾是剧毒药,使用时应小心,切勿沾染,以免中毒。夏天分装培养基应在冰箱内进行。试验失败的主要原因是封口不严,氰化钾逐渐分解,产生氢氰酸气体逸出,以致药物浓度降低,细菌生长,因而造成假阳性反应。试验时对每一环节都要特别注意。
A.10 氧化酶试剂
A.10.1 成分
|
N,N’-二甲基对苯二胺盐酸盐或 N,N,N’,N’-四甲基对苯二胺盐酸盐 |
1.0 g |
|
蒸馏水 |
100mL |
A.10.2 制法
少量新鲜配制,于冰箱内避光保存,在7d内使用。
A.10.3 试验方法
用无菌棉拭子取单个菌落,滴加氧化酶试剂,10s内呈现粉红或紫红色即为氧化酶试验阳性,不变色者为氧化酶试验阴性。
A.11 革兰氏染色液
A.11.1结晶紫染色液
A.11.1.1成分
|
结晶紫 |
1.0g |
|
95%乙醇 |
20.0 mL |
|
1%草酸铵水溶液 |
80.0 mL |
A.111.2 制法
将结晶紫完全溶解于乙醇中,然后与草酸铵溶液混合。
A.11.2革兰氏碘液
A.11.2.1成分
|
碘 |
1.0g |
|
碘化钾 |
2.0g |
|
蒸馏水 |
300 mL |
A.11.2.2 制法
将碘与碘化钾先行混合,加入蒸馏水少许充分振摇,待完全溶解后,再加蒸馏水至300mL。
A.11.3 沙黄复染液
A.7.3.1 成分
|
沙黄 |
0.25g |
|
95%乙醇 |
10mL |
|
蒸馏水 |
90mL |
A.11.3.2制法
将沙黄溶解于乙醇中,然后用蒸馏水稀释。
A.11.4 染色法
A.11.4.1 涂片在火焰上固定,滴加结晶紫染液,染1min,水洗。
A.11.4.2 滴加革兰氏碘液,作用1min,水洗。
A.11.4.3 滴加95%乙醇脱色约15s~30s,直至染色液被洗掉,不要过分脱色,水洗。
A.11.4.4 滴加复染液,复染1min,水洗、待干、镜检。
A.12 BHI肉汤
A.12.1 成分
|
小牛脑浸液 |
200g |
|
牛心浸液 |
250g |
|
蛋白胨 |
10.0g |
|
NaCl |
5.0g |
|
葡萄糖 |
2.0g |
|
磷酸氢二钠(Na2HPO4) |
2.5g |
|
蒸馏水 |
1 000 mL |
pH 7.4±0.2
A.12.2 制法
按以上成分配好,加热溶解,冷却至25 ℃左右校正pH至 7.4±0.2,分装小试管。121 ℃灭菌 15 min。
上一篇:世界上最致命病毒排行榜



