

 海博微信公众号
海博微信公众号
 海博天猫旗舰店
海博天猫旗舰店


 海博微信公众号
海博微信公众号
 海博天猫旗舰店
海博天猫旗舰店




1 范围
本标准规定了食品中霉菌和酵母(moulds and yeasts)的计数方法。
本标准适用于各类食品中霉菌和酵母的计数。
2 设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:
2.1 培养箱:28 ℃±1 ℃。
2.2 拍击式均质器及均质袋。
2.3 电子天平:感量0.1 g。
2.4 无菌锥形瓶:容量500 mL。
2.5 无菌吸管:1 mL(具0.01 mL刻度)、10 mL(具0.1 mL刻度)。
2.6 无菌试管: 18 mm×180 mm。
2.7 旋涡混合仪。
2.8 无菌平皿:直径90 mm。
2.9 恒温水浴箱:46 ℃±1 ℃。
2.10 显微镜:10×。
3 培养基和试剂
3.1 生理盐水:见附录A中A.1。
3.2 马铃薯葡萄糖琼脂:见附录A中A.2。
3.3 孟加拉红琼脂:见附录A中A.3。
4 检验程序
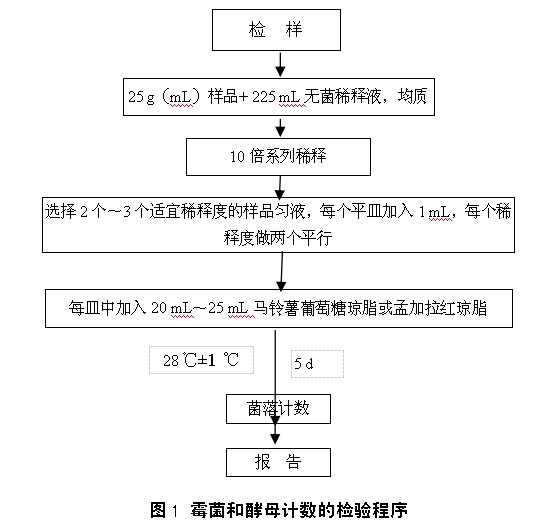
5 操作步骤
5.1 样品的稀释
5.1.1 固体和半固体样品:称取25 g样品,加入225 mL无菌稀释液(水或生理盐水),充分振摇,或用拍击式均质器拍打2 min,制成1:10的样品匀液。
5.1.2 液体样品:以无菌吸管吸取25 mL样品至盛有225 mL无菌稀释液(水或生理盐水)的锥形瓶(可在瓶内预置适当数量的无菌玻璃珠)或无菌均质袋中,充分振摇或用拍击式均质器拍打2 min,制成1:10的样品匀液。
5.1.3 取1 mL 1:10样品匀液注入含有9 mL无菌稀释液的试管中,另换一支1 mL无菌吸管反复吹吸,或在旋涡混合仪上混匀,此液为1:100的样品匀液。
5.1.4 按5.1.3操作程序,制备10倍递增系列稀释样品匀液。每递增稀释一次,换用1支1 mL无菌吸管。
5.1.5 根据对样品污染状况的估计,选择2个~3个适宜稀释度的样品匀液(液体样品可包括原液),在进行10倍递增稀释的同时,每个稀释度分别吸取1 mL样品匀液于2个无菌平皿内。同时分别取1 mL无菌稀释液加入2个无菌平皿作空白对照。
5.1.6 及时将20 mL~25 mL冷却至46 ℃的马铃薯葡萄糖琼脂或孟加拉红琼脂(可放置于46 ℃±1 ℃恒温水浴箱中保温)倾注平皿,并转动平皿使其混合均匀。置水平台面待培养基完全凝固。
5.2 培养
琼脂凝固后,正置平板,置28 ℃±1 ℃培养箱中培养,观察并记录,培养至第5 d的结果。
5.3 菌落计数
用肉眼观察,必要时可用放大镜或低倍镜,记录稀释倍数和相应的霉菌和酵母菌落数。以菌落形成单位(colony-forming units,CFU)表示。
选取菌落数在10 CFU~150 CFU的平板,根据菌落形态分别计数霉菌和酵母。霉菌蔓延生长覆盖整个平板的可记录为菌落蔓延。
6 结果与报告
6.1 结果
6.1.1 计算同一稀释度的两个平板菌落数的平均值,再将平均值乘以相应稀释倍数。
6.1.2 若有两个稀释度平板上菌落数均在10 CFU~150 CFU之间,则按照GB 4789.2的相应规定进行计算。
6.1.3 若所有平板上菌落数均大于150 CFU,则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算。
6.1.4 若所有平板上菌落数均小于10 CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
6.1.5 若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
6.2 报告
6.2.1 菌落数按“四舍五入”原则修约。菌落数在10以内时,采用一位有效数字报告;菌落数在10~100之间时,采用两位有效数字报告。
6.2.2 菌落数大于或等于100时,前第3位数字采用“四舍五入”原则修约后,取前2位数字,后面用0代替位数来表示结果;也可用10的指数形式来表示,此时也按“四舍五入”原则修约,采用两位有效数字。
6.2.3 若空白对照平板上有菌落出现,则此次检测结果无效。
6.2.4 称重取样以CFU/g为单位报告,体积取样以CFU/mL为单位报告,报告或分别报告霉菌和/或酵母数。
附 录A
培养基和试剂
A.1 生理盐水
A.1.1 成分
氯化钠 8.5 g
蒸馏水 1 000 mL
A.1.2 制法
氯化钠加入1000 mL蒸馏水中,搅拌至完全溶解,分装后,121 ℃灭菌20 min,备用。
A.2 马铃薯葡萄糖琼脂
A.2.1 成分
马铃薯(去皮切块) 300 g
葡萄糖 20.0 g
琼脂 20.0 g
氯霉素 0.1 g
蒸馏水 1 000 mL
A.2.2 制法
将马铃薯去皮切块,加1000 mL蒸馏水,煮沸10 min~20 min。用纱布过滤,补加蒸馏水至1000 mL。加入葡萄糖和琼脂,加热溶解,分装后,121 ℃灭菌20 min,备用。
A.3 孟加拉红琼脂
A.3.1 成分
蛋白胨 5.0 g
葡萄糖 10.0 g
磷酸二氢钾 1.0 g
硫酸镁(无水) 0.5 g
琼脂 20.0 g
孟加拉红 0.033 g
氯霉素 0.1 g
蒸馏水 1 000 mL
A.3.2 制法
上述各成分加入蒸馏水中,加热溶解,补足蒸馏水至1 000 mL,分装后,121℃灭菌20 min,避光保存备用。
附 录B
霉菌直接镜检计数法
常用的为郝氏(Howard)霉菌计测法,本方法适用于番茄酱罐头、番茄汁。
B.1 设备和材料
B.1.1 折光仪。
B.1.2 显微镜。
B.1.3 郝氏计测玻片:具有标准计测室的特制玻片。
B.1.4 盖玻片。
B.1.5 测微器:具标准刻度的玻片。
B.2 操作步骤
B.2.1 检样的制备:取定量检样,加蒸馏水稀释至折光指数为1.3447~1.3460(即浓度为7.9%~8.8%),备用。
B.2.2 显微镜标准视野的校正:将显微镜按放大率90~125倍调节标准视野,使其直径为1.382mm。
B.2.3 涂片:洗净郝氏计测玻片,将制好的标准液,用玻璃棒均匀的摊布于计测室,加盖玻片,以备观察。
B.2.4 观测:将制好之载玻片置于显微镜标准视野下进行观测。一般每一检样每人观察50个视野。同一检样应由两人进行观察。
B.2.5 结果与计算:在标准视野下,发现有霉菌菌丝其长度超过标准视野(1.382 mm)的1/6或三根菌丝总长度超过标准视野的1/6(即测微器的一格)时即记录为阳性(+),否则记录为阴性(-)。
B.2.6 报告:报告每100个视野中全部阳性视野数为霉菌的视野百分数(视野%)。
上一篇:病原微生物快速检测方法及研究进展



