

 海博微信公众号
海博微信公众号
 海博天猫旗舰店
海博天猫旗舰店


 海博微信公众号
海博微信公众号
 海博天猫旗舰店
海博天猫旗舰店




大肠菌群是指在一定培养条件下能发酵乳糖、产酸产气的需氧和兼性厌氧革兰氏阴性无芽胞杆菌。
直接或间接来自人与温血动物的肠道:包括肠杆菌科的大肠埃希氏菌属、柠檬酸杆菌属、肠杆菌属和克雷伯菌属,其中大肠埃希氏菌属为最典型大肠埃希氏菌。
人与温血动物粪便污染的指示菌:
• 大肠埃希氏菌——粪便近期污染;
• 其他菌属——粪便陈旧污染。
肠道致病菌污染食品的指示菌:
• 与肠道致病菌(如沙门氏菌、志贺氏菌)来源相同;在外界生存的时间与主要肠道致病菌一致。
二、修订的主要内容
本标准与GB4789.2-2010相比,主要修改如下:
1、删除了标准的英文名称
2、修改了发布单位名称
2010版本“中华人民共和国卫生部”
2016版本“中华人民共和国国家卫生盒计划生育委员会”和“国家食品药品监督管理总局”
3、前言:
本标准代替GB4789.3—2010《食品安全国家标准 食品微生物学检验 大肠菌群计数》、GB/T4789.32—2002《食品卫生微生物学检验 大肠菌群的快速检测》和SN/T0169—2010《进出口食品中大肠菌群、粪大肠菌群和大肠杆菌检测方法》大肠菌群计数部分。
本标准与GB4789.3—2010相比,主要变化如下:
———增加了检验原理;
———修改了适用范围;
———修改了典型菌落的形态描述;
———修改了第二法平板菌落数的选择;
———修改了第二法证实试验;
———修改了第二法平板计数的报告。
三、大肠菌群计数的两种方法
第一法 MPN法
适用于大肠菌群含量较低的食品中大肠菌群的计数。
检验原理:MPN法是统计学和微生物学结合的一种定量检测法。待测样品经系列稀释并培养后,根据其未生长的最低稀释度与生长的最高稀释度,应用统计学概率论推算出待测样品中大肠菌群的最大可能数。
第二法 平板计数法
适用于大肠菌群含量较高的食品中大肠菌群的计数。
检验原理:大肠菌群在固体培养基中发酵乳糖产酸,在指示剂的作用下形成可计数的红色或紫色,带有或不带有沉淀环的菌落。
MPN法检验操作
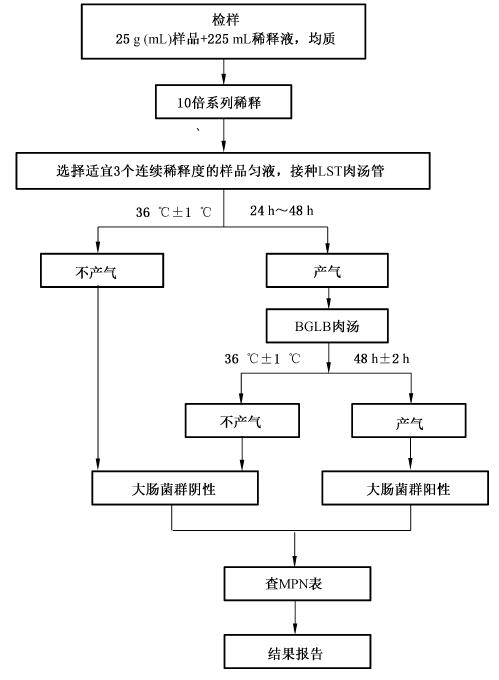
第一步:样品稀释
1 固体和半固体样品:称取25g样品,放入盛有225mL磷酸盐缓冲液或生理盐水的无菌均质杯内8000r/min~10000r/min均质1min~2min,或放入盛有225mL磷酸盐缓冲液或生理盐水的无菌均质袋中,用拍击式均质器拍打1min~2min,制成1∶10的样品匀液。
2 液体样品:以无菌吸管吸取25mL样品置盛有225mL磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)或其他无菌容器中充分振摇或置于机械振荡器中振摇,充分混匀,制成1∶10的样品匀液。
3 样品匀液的pH 应在6.5~7.5之间,必要时分别用1mol/LNaOH 或1mol/LHCl调节。
4 用1mL 无菌吸管或微量移液器吸取1∶10样品匀液1mL,沿管壁缓缓注入9mL磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用1支1mL无菌吸管反复吹打,使其混合均匀,制成1∶100的样品匀液。
5 根据对样品污染状况的估计,按上述操作,依次制成十倍递增系列稀释样品匀液。每递增稀释1次,换用1支1mL无菌吸管或吸头。从制备样品匀液至样品接种完毕,全过程不得超过15min。
第二步:初发酵试验
每个样品,选择3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管接种1mL(如接种量超过1mL,则用双料LST肉汤),36℃±1℃ 培养24h±2h,观察倒管内是否有气泡产生,24h±2h产气者进行复发酵试验(证实试验),如未产气则继续培养至48h±2h,产气者进行复发酵试验。未产气者为大肠菌群阴性。
初发酵实验培养基:月桂基硫酸盐蛋白胨肉汤(LST)
成分
胰蛋白胨20.0g提供氮源
氯化钠5.0g调节渗透压
乳糖5.0g提供碳源、指示系统
磷酸氢二钾2.75g调节pH
磷酸二氢钾2.75g调节pH
月桂基硫酸钠0.1g抑制革兰氏阳性菌生长
PH值6.8±0.2 25℃
用 法
称取本品35.6克,加热溶解于1000ml蒸馏水中,分装到有倒立发酵管的20mm×150mm试管中,每管10ml,121℃高压灭菌15分钟,备用。
第三步:复发酵试验(证实试验)
用接种环从产气的LST肉汤管中分别取培养物1 环,移种于煌绿乳糖胆盐肉汤(BGLB)管中,36℃±1℃培养48h±2h,观察产气情况。产气者,计为大肠菌群阳性管。
复发酵实验培养基:煌绿乳糖胆盐肉汤(BGLB)
成分
蛋白胨10.0g提供氮源
乳糖10.0g提供碳源并作为指示剂
牛胆粉(oxgall或oxbile)溶液200mL抑制革兰阳性菌生长
0.1%煌绿水溶液13.3mL抑制革兰阳性菌和部分阴性菌生长
蒸馏水800ml
pH值 7.2±0.1 25℃


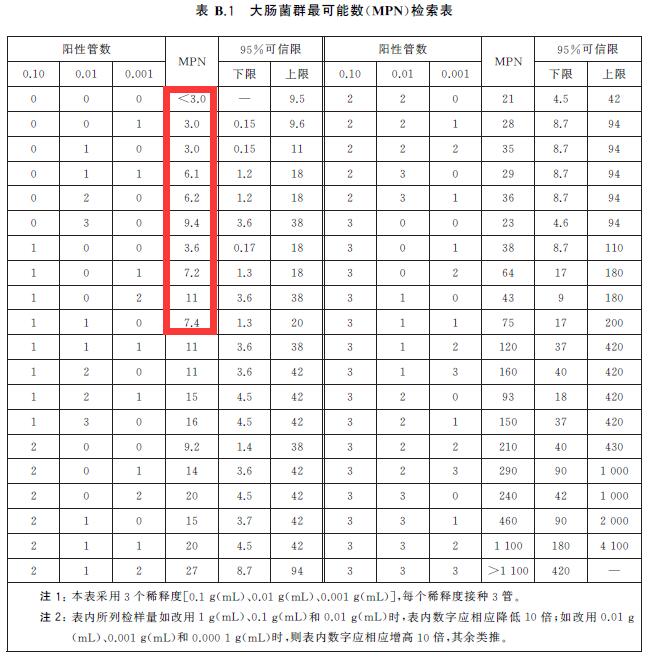
第四步:大肠菌群最可能数(MPN)的报告
按确证的大肠菌群BGLB阳性管数,检索MPN 表,报告每g(mL)样品中大肠菌群的MPN 值。
模式:大肠菌群(MPN/g) <0.3
大肠菌群(MPN/ml)<0.03
稀释度的选择
依据国家食品安全标准,一般情况下:
固体样品选作1g*3、0.1g*3、0.01g*3,若结果全部阴性,报告为<0.3MPN/g;若有阳性管,查表,表中数字除以10报告。
液体样品选作10ml*3、1ml*3、0.01ml*3,若结果全部阴性,报告为<0.03MPN/g;若有阳性管,查表,表中数字除以100报告。
平板计数法检验操作

第一步:样品的稀释
同MPN法。
第二步:平板计数
1 选取2个~3个适宜的连续稀释度,每个稀释度接种2个无菌平皿,每皿1mL。同时取1mL生理盐水加入无菌平皿作空白对照。
2 及时将15mL~20mL融化并恒温至46℃的结晶紫中性红胆盐琼脂(VRBA)约倾注于每个平皿中。小心旋转平皿,将培养基与样液充分混匀,待琼脂凝固后,再加3mL~4mLVRBA 覆盖平板表层。翻转平板,置于36℃±1℃培养18h~24h。
所用培养基:结晶紫中性红胆盐琼脂(VRBA)
成分
蛋白胨7.0g提供氮源
酵母膏3.0g提供氮源,生长因子
乳糖10.0g提供碳源、指示剂
氯化钠5.0g维持渗透压
胆盐或3号胆盐1.5g抑制革兰氏阳性菌生长
中性红0.03g pH指示剂
结晶紫0.002g抑制革兰氏阳性菌生长
琼脂15g~18g凝固剂
蒸馏水1000mL
制法
将上述成分溶于蒸馏水中,静置几分钟,充分搅拌,调节pH 至7.4±0.1。煮沸2min,将培养基融化并恒温至45℃~50℃倾注平板。使用前临时制备,不得超过3h。

第三步:平板菌落数的选择
选取菌落数在15CFU~150CFU 之间的平板,分别计数平板上出现的典型和可疑大肠菌群菌落(如菌落直径较典型菌落小)。典型菌落为紫红色,菌落周围有红色的胆盐沉淀环,菌落直径为0.5mm或更大,最低稀释度平板低于15CFU 的记录具体菌落数。
第四步:证实试验
从VRBA 平板上挑取10个不同类型的典型和可疑菌落,少于10个菌落的挑取全部典型和可疑菌落。分别移种于BGLB肉汤管内,36℃±1℃培养24h~48h,观察产气情况。凡BGLB肉汤管产气,即可报告为大肠菌群阳性。
第五步:大肠菌群平板计数的报告
经最后证实为大肠菌群阳性的试管比例乘以9.3中计数的平板菌落数,再乘以稀释倍数,即为每g(mL)样品中大肠菌群数。例:10-4样品稀释液1mL,在VRBA 平板上有100个典型和可疑菌落,挑取其中10个接种BGLB肉汤管,证实有6个阳性管,则该样品的大肠菌群数为:100×6/10×104/g(mL)=6.0×105CFU/g(mL)。若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
上一篇:食品保质期的相关知识
下一篇:大肠菌群平板计数法常见问题



