

 海博微信公众号
海博微信公众号
 海博天猫旗舰店
海博天猫旗舰店


 海博微信公众号
海博微信公众号
 海博天猫旗舰店
海博天猫旗舰店




一、内毒素简介
细菌内毒素(Endotoxin)是革兰氏阴性菌细胞壁外膜的关键组成成分,其化学本质为脂多糖(LPS),在细菌死亡裂解大量释放或主动分泌时少量释放到环境中。内毒素广泛分布于自然环境的各个角落,医院、实验室、制药车间等场所因频繁接触微生物,成为内毒素污染的高风险区域。
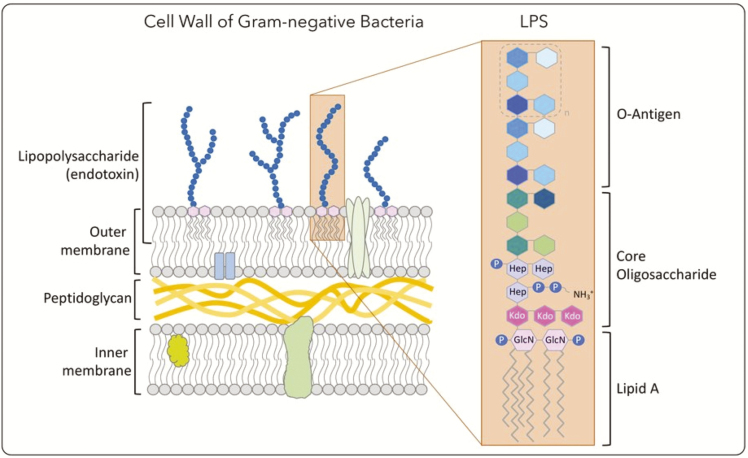
图1 内毒素结构示意图(图片引自Monteiro和Faciola,2020)ADDIN NE.Ref.{EC8DDAE3-1995-4BCD-9BDE-B91BC7F8BD9D}[1]
内毒素单体分子量为10kDa左右,在水溶液中可形成大分子聚集体,最大可超过1000 kDa,在药物溶液中呈现净负电荷。带负电荷的“胶束”内毒素可以吸附在多聚阳离子配体上,或者可以通过疏水脂质尾部与疏水表面发生相互作用。从结构上看,内毒素由类脂A、核心多糖和O抗原三部分构成。其中类脂A是人类免疫系统识别的主要脂多糖表位,决定了其致热、引发炎症反应等毒性作用;核心多糖具有种属特异性,主要作用是连接类脂A和O抗原;而O抗原由2~6个寡聚糖组成,是LPS中最容易发生变异的部分。这种特殊结构使其具备极强的稳定性,常规的高温灭菌(如100℃煮沸)难以破坏其结构,需在250℃干热条件下持续30分钟或180℃处理2小时才能实现有效灭活。
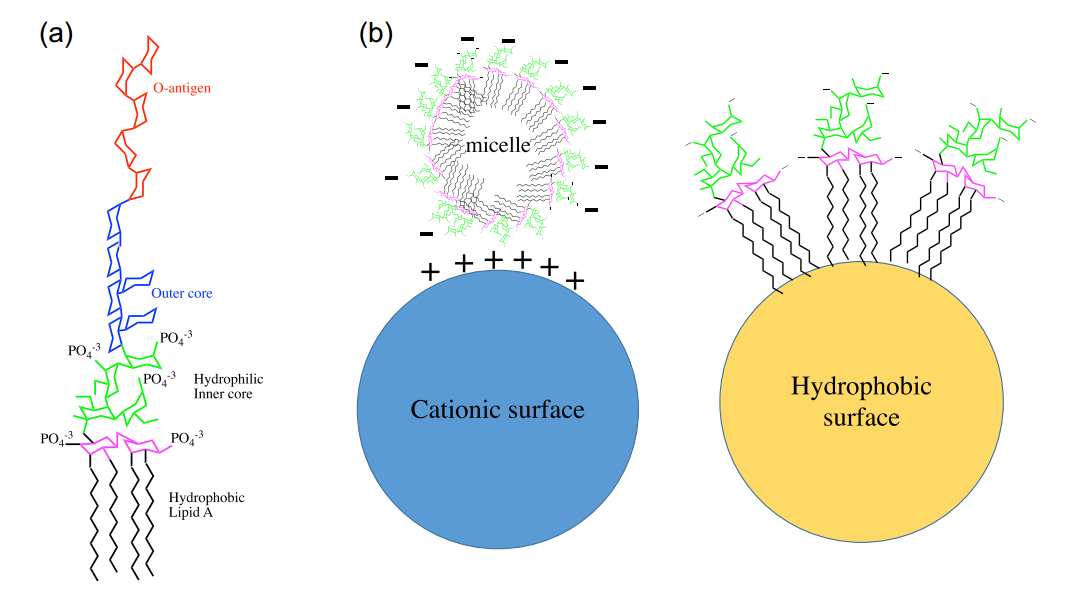
图2 (a)来自大肠杆菌内毒素的化学结构示意图,(b)内毒素以胶束,立方体,层状或囊泡的形式聚集(图片引自Schneier和Razdan,2020)ADDIN NE.Ref.{CC0B34E6-1785-43CF-82ED-9572F90406B6}[2]
内毒素的危害不容小觑。在临床诊疗中,若试剂或医疗器械中内毒素超标,进入人体后会激活机体的免疫系统,引发发热、寒战、低血压甚至脓毒症休克等严重不良反应,对患者生命安全构成极大威胁。相关资料表明每小时每公斤体重仅1 ng的内毒素就可引起热原反应。内毒素测量的标准单位是内毒素单位(EU),相当于0.1 ng大肠杆菌内毒素的活性。对于静脉注射,每小时最多可以给患者注射5 EU/Kg的内毒素,可接受的浓度取决于所需剂量ADDIN NE.Ref.{427F2C58-210E-4B58-82A7-DAAF675615AE}[2]。在生物制药领域,内毒素会干扰细胞培养体系,影响蛋白质折叠与活性,导致生物制品质量不合格。在科研实验中,它可能改变实验动物的生理状态,干扰检测结果的准确性,如在细胞因子检测实验中,内毒素会非特异性激活免疫细胞,导致检测值虚高。
目前,内毒素检测的常用方法是鲎试验法,该方法利用鲎血变形细胞裂解物与内毒素的特异性反应,通过浊度变化或显色反应实现定量检测。随着技术发展,鲎试验法衍生出动态浊度法、终点显色法等多种检测形式,内毒素检测浓度可达 0.001EU/mL,能满足不同场景的检测需求。此外,基于重组因子C的检测方法因无需依赖鲎资源,逐渐成为替代方案,在欧盟等地区已广泛应用。
二、内毒素的控制和去除方法
(一)器具中内毒素的去除方法
实验用具、仪器设备等器具是内毒素污染的重要载体,其清洁处理直接影响试剂的内毒素水平。针对不同材质和用途的器具,需采用差异化的去除策略。
1、干热法
高温干热是玻璃器皿、金属器械等耐高温器具除内毒素的首选方法,可以在灭菌的同时有效降低内毒素含量。常规处理方法是,在180℃条件下处理2小时到4小时、200℃处理1小时到2小时或250℃处理至少30分钟,可使器具表面内毒素含量降低至0.01EU以下。处理时需注意将器具均匀分布在灭菌箱内,避免堆叠遮挡,确保热传递均匀。对于带有精密刻度的玻璃量具,需在灭菌后进行校准,防止高温导致的容积误差。
2、化学降解法
酸碱处理法适用于玻璃、塑料、橡胶和其它高分子材料器具。处理方法有:3%-5%双氧水、重铬酸钾硫酸清洁液、0.1mol/L HCl或0.1mol/L NaOH浸泡,一般处理4小时以上。常用0.1mol/L NaOH溶液浸泡器具,利用强碱对脂多糖的水解作用破坏内毒素结构。处理后需用无菌且无热原水冲洗至少10次,确保残留碱液完全清除,避免对后续试剂造成干扰。值得注意的是,如采用化学降解处理,则需要注意器具材料对化学试剂的耐受性能(如聚氯乙烯(PVC)材质器具不宜采用强酸处理)以免发生腐蚀变形。
3、氧化处理
氧化灭菌技术包括臭氧消毒和过氧化氢熏蒸。臭氧凭借强氧化性可破坏内毒素的多糖链结构,对密闭空间内的器具表面消毒效果显著。过氧化氢熏蒸则适用于生物安全柜、无菌隔离器等大型设备内部器具的消毒,通过汽化的过氧化氢分子渗透至缝隙处,实现全方位灭菌。
4、其他处理方法
超声清洗结合化学去污的协同方法,可通过机械振动与酶解作用分解内毒素-蛋白质复合物,能有效去除器具表面的生物膜及内毒素残留。该方法更适用于吸管、针头、阀门等带有细孔结构的器具。此外,部分不耐热的器具(如密封圈等)可以通过γ辐照、环氧乙烷等方式进行独立灭菌,可在有效灭菌的同时,降低内毒素的含量。
(二)原材料中内毒素的去除方法
原材料作为试剂内毒素的主要来源,其质量控制是降低最终产品内毒素含量的关键环节。需从采购筛选、预处理纯化等多环节构建防控体系。
源头管控方面,应建立原材料供应商的内毒素标准(如原辅料内毒素≤0.1EU/mg,注射用水内毒素≤0.25EU/mL),要求提供每批次的鲎试验报告,对于关键原材料(如血清、酶制剂)应筛选低内毒素批次。同时,原材料的储存条件需严格控制,2℃-8℃冷藏可减缓内毒素释放,而反复冻融会导致细菌裂解,使内毒素含量升高,因此建议采用单次使用的分装保存。
对于固体试剂常依据试剂熔点行不同的除内毒素处理,若试剂的熔点高于180℃,可在溶解前将固体试剂用180℃干热4小时到5小时,可去除试剂中的水分和内毒素。若试剂熔点低于180℃,常使用80℃过夜处理。处理后采用去内毒素的水溶解烘过的试剂,之后按照需求可进行定容、调节pH、过滤或内毒素检测等工作。
对于液体可采用液相分离、超滤、层析和吸附等方法进行处理。
1、液相分离法
一些试剂,如Triton X-114、脱氧胆酸钠、多黏菌素B能够和内毒素的脂质部分结合,通过液相分离的方法萃取内毒素从而使后者有效地去除。除此之外,聚阳离子、氨基酸和季铵盐等试剂也可起到去除内毒素作用,但需要注意试剂残留的风险。
2、超滤法
超滤技术在液体原材料的内毒素去除中应用广泛。单个内毒素分子的分子量通常在10kDa-30kDa之间,而它们聚集形成的胶束和囊泡的分子量高达1000kDa、直径约0.1µm,因此可选择合适的超滤膜(截留分子量≤10kDa,通常采用截留分子量5kDa的UF超滤膜)去除溶液中的内毒素,该方法适合从相对分子质量较小的溶液中去除内毒素。需注意0.22µm过滤除菌并不能去除溶解状态内毒素,需与超滤联用。
3、层析纯化法
亲和层析法基于内毒素与配体的特异性结合实现精准去除。固定化多粘菌素B的层析柱对脂多糖具有高度亲和力,在pH 7.4的磷酸盐缓冲液中,内毒素结合率可达95%以上。洗脱时采用含2%脱氧胆酸钠的缓冲液,可有效回收吸附的内毒素,实现层析柱的再生。该方法尤其适用于抗体、疫苗等生物制品原材料的纯化,能在保持目标成分活性的同时降低内毒素含量。
离子交换色谱法:当溶液pH大于2时,内毒素带有负电荷。因此内毒素与阴离子交换介质有较强结合。柱上的内毒素可在洗脱目标蛋白后用高盐缓冲液或NaOH去除。该方法的优点是成本低,吸附容量大,但不适合于溶液中存在其它带负电荷物质的情况。
疏水层析法:内毒素的脂肪A部份有很强的疏水性,但在高盐情况下会凝集,无法结合疏水层析柱。因此可选择能结合目标蛋白的疏水介质去除内毒素,适用于高盐浓度的样品。
生物制品可优先采用离子交换、亲和层析等去除内毒素。
4、吸附法
活性炭用于去除内毒素是由于内毒素的相对分子质量较大。适合于组分较为简单的小分子的溶液中或水中去除内毒素。活性炭常用量为0.1%~0.5%。该方法的优点是成本低,处理量大。缺点则是活性炭的选择性较差,易吸附有效成份,纯化后溶液中的残余活性炭不易去除,且自身可能含有的重金属造成样品污染,因此目前很少使用。
通过上述针对使用器具和试剂原材料的内毒素管控,可显著降低试剂内毒素污染风险,确保最终试剂内毒素含量符合质量标准。在实际操作中,需结合试剂的理化性质选择适宜的去除方法,平衡内毒素去除效率与试剂稳定性,构建科学合理的内毒素控制体系。
三、产品展示
青岛高科技工业园海博生物技术有限公司生产的PBS和DPBS缓冲液产品,均采用过滤除菌工艺进行无菌灌装,每批产品均经过严格的质量控制测试,包括无菌测试、pH、渗透压、内毒素等测试,内毒素含量不超过0.01 EU/mL。产品详情请参考:常见的细胞平衡盐溶液介绍及选择(常见的细胞平衡盐溶液介绍及选择)以及PBS和DPBS产品(细胞培养基、缓冲液、洗脱液系列)。
四、参考文献ADDIN NE.Bib
[1] Monteiro H F, Faciola A P. Ruminal acidosis, bacterial changes, and lipopolysaccharides[J]. Journal of Animal Science, 2020,98(8):skaa248.
[2] Schneier M, Razdan S, Miller A M, et al. Current technologies to endotoxin detection and removal for biopharmaceutical purification[J]. Biotechnology and Bioengineering, 2020,117(8):2588-2609.
注:本文属海博生物原创,未经允许不得转载。
| 相关文章: | ||



