1 方法来源
FDA/BAM Chapter 9 Vibrio2004
2 适用范围
本程序规定了食品中创伤弧菌(Vibrio vulnificus)的检验方法。本程序适用于食品中创伤弧菌的检验。
3 设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下。
3.1 恒温培养箱:36℃±1℃、39.5℃±0.5℃。
3.2 冰箱:2℃~5℃、7℃~10℃。
3.3 恒温水浴箱:36℃±1℃。
3.4 均质器或无菌乳钵。
3.5 天平:感量0.1 g。
3.6 无菌试管:18 mm×180mm、15mm×100mm。
3.7 无菌吸管:1mL(具0.01mL刻度)、10mL(具0.1mL刻度)或微量移液器及吸头。
3.8 无菌锥形瓶:容量250mL、500 mL、1000mL。
3.9 无菌培养皿:直径90mm。
3.10 无菌手术剪、镊子。
3.11 PCR仪。
3.12 电泳装置。
3.13 凝胶分析成像系统。
3.14 PCR超净工作台。
3.15 高速台式离心机(15000r/min)。
3.16 微量可调移液器(2μL、10μL、100μL、1000μL)和相应吸头。
4 培养基和试剂
4.1 3%氯化钠碱性蛋白胨水:见附录A中A.1。
4.2 改良纤维二糖-多粘菌素B-多粘菌素E(mCPC)琼脂:见附录A中A.2。
4.3 纤维二糖-多粘菌素E(CC)琼脂:见附录A中A.3。
4.4 3%氯化钠胰蛋白胨大豆琼脂:见附录A中A.4。
4.5 3%氯化钠三糖铁琼脂:见附录A中A.5。
4.6 嗜盐性试验培养基:见附录A中A.6。
4.7 3%氯化钠赖氨酸脱羧酶试验培养基:见附录A中A.7。
4.8 3%氯化钠MR-VP培养基:见附录A中A.8。
4.9 3%氯化钠溶液:见附录A中A.9。
4.10 氧化酶试剂:见附录A中A.10。
4.11 革兰氏染色液:见附录A中A.11。
4.12 邻硝基酚-β-D-半乳糖苷(ONPG)试剂:见附录A中A.12。
4.13 Voges-Proskauer(V-P)试剂:见附录A中A.13。
4.14 生化鉴定试剂盒。
4.15 DNA提取液。
4.16 6×上样缓冲液。
4.17 0.5×TBE。
4.18 琼脂糖。
4.19 DNA分子量标记物(100 bp-1000 bp)。
4.20 PCR反应配套试剂。
第一法 定性检验
5 检验程序
创伤弧菌检验程序见图1。
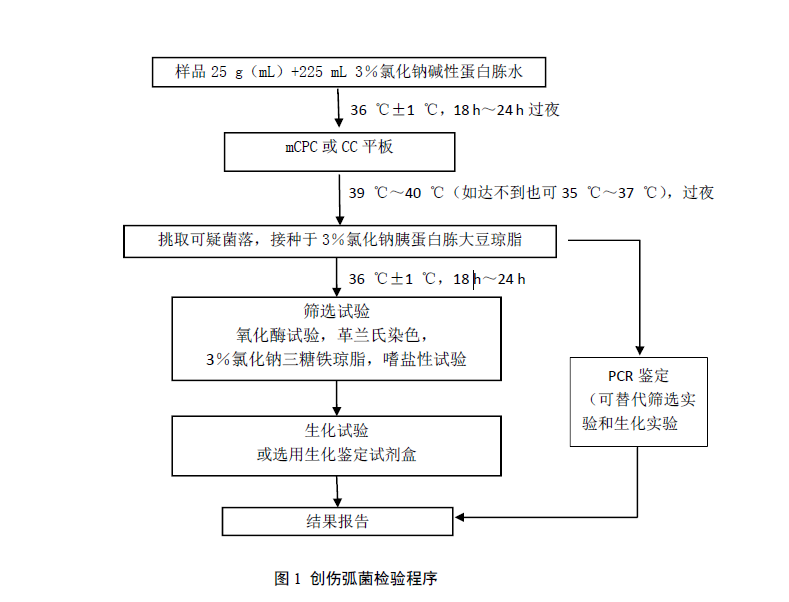
6 操作步骤
6.1 样品制备
6.1.1 非冷冻样品采集后应立即置7℃~10℃冰箱保存,尽可能及早检验;冷冻样品应在45 ℃以下不超过15min或在2 ℃~5 ℃不超过18 h解冻。
6.1.2 鱼类和头足类动物取表面组织、肠或鳃。贝类取全部内容物,包括贝肉和体液;甲壳类取整个动物,或者动物的中心部分,包括肠和鳃。如为带壳贝类或甲壳类,则应先在自来水中洗刷外壳并甩干表面水分,然后以无菌操作打开外壳,按上述要求取相应部分。
6.1.3 以无菌操作取样品25g(mL),加入3%氯化钠碱性蛋白胨水225mL,用旋转刀片式均质器以8000r/min~10000r/min均质1min~2min,或拍击式均质器拍击1min~2min,制备成1:10的样品匀液。如无均质器,则将样品放入无菌乳钵,自225mL3%氯化钠碱性蛋白胨水中取少量稀释液加入无菌乳钵,样品磨碎后放入500mL无菌锥形瓶,再用少量稀释液冲洗乳钵中的残留样品1~2次,洗液放入锥形瓶,最后将剩余稀释液全部放入锥形瓶,充分振荡,制备1:10的样品匀液。
6.2 增菌
将上述1:10样品匀液于36℃±1℃培养18 h~24 h。
6.3 分离
6.3.1 对所有显示生长的增菌液,用接种环在距离液面以下1cm内沾取一环增菌液,于mCPC或CC平板上划线分离。于39℃~40 ℃过夜培养(如果达不到39 ℃~40 ℃,则35 ℃~37 ℃)。
6.3.2 典型的创伤弧菌在mCPC和CC平板上呈现为圆的、扁平的、中心不透明边缘透明的黄色菌落,直径1 mm~2 mm。
6.4 纯培养
挑取3个或以上可疑菌落,划线接种3%氯化钠胰蛋白胨大豆琼脂平板,36℃±1℃培养18 h~24 h。
6.5 初步鉴定
6.5.1 氧化酶试验:挑选纯培养的单个菌落进行氧化酶试验,创伤弧菌为氧化酶阳性。
6.5.2 涂片镜检:将可疑菌落涂片,进行革兰氏染色,镜检观察形态。创伤弧菌为革兰氏阴性,呈棒状、弧状、卵圆状等多形态,无芽胞,有鞭毛。
6.5.3 挑取纯培养的单个可疑菌落,转种3%氯化钠三糖铁琼脂斜面并穿刺底层,36℃±1℃培养24 h观察结果。创伤弧菌在3%氯化钠三糖铁琼脂中的反应为底层变黄不变黑,无气泡,斜面颜色不变或红色加深,偶尔斜面变黄。
6.5.4 嗜盐性试验:挑取纯培养的单个可疑菌落,分别接种0%、6%、8%和10%不同氯化钠浓度的胰胨水,36℃±1 ℃培养24 h,观察液体混浊情况。创伤弧菌在无氯化钠、8%氯化钠和10%氯化钠的胰胨水中不生长或微弱生长,在6%氯化钠的胰胨水中生长旺盛。
6.6 确证鉴定
取纯培养物分别接种含3%氯化钠的赖氨酸脱羧酶试验培养基、MR-VP培养基,36℃±1℃培养24 h~48 h后观察结果;3%氯化钠三糖铁琼脂隔夜培养物进行ONPG试验。可选择生化鉴定试剂盒。创伤弧菌的生化性状见表1,创伤弧菌主要性状与其他弧菌的鉴别见表2。
表1 创伤弧菌的生化性状
|
试验项目 |
结果 |
|
革兰氏染色镜检 |
阴性,棒状或弧状 |
|
氧化酶 |
+ |
|
动力 |
+ |
|
D-纤维二糖 |
+ |
|
蔗糖 |
- |
|
葡萄糖 |
+ |
|
分解葡萄糖产气 |
- |
|
乳糖 |
+ |
|
硫化氢 |
- |
|
赖氨酸脱羧酶 |
+ |
|
V-P |
- |
|
ONPG |
+ |
|
注:+阳性;-阴性。 |
|
表2 创伤弧菌主要性状与其他弧菌的鉴别
|
名称 |
氧 化 酶 |
赖 氨 酸 |
精 氨 酸 |
鸟 氨 酸 |
明 胶 |
脲 酶 |
V ︱ P |
42 ℃ 生 长 |
蔗 糖 |
D ︱ 纤 维 二 糖 |
乳 糖 |
阿 拉 伯 糖 |
D ︱ 甘 露 糖 |
D ︱ 甘 露 醇 |
ONPG |
嗜盐性试验 NaCl含量(%) |
||||
|
0 |
3 |
6 |
8 |
10 |
||||||||||||||||
|
创伤弧菌 |
+ |
+ |
- |
+ |
+ |
- |
- |
+ |
- |
+ |
+ |
- |
+ |
V |
+ |
- |
+ |
+ |
- |
- |
|
副溶血性弧菌 V. parahaemolyticus |
+ |
+ |
- |
+ |
+ |
V |
- |
+ |
- |
V |
- |
+ |
+ |
+ |
- |
- |
+ |
+ |
+ |
- |
|
溶藻弧菌 V. alginolyticus |
+ |
+ |
- |
+ |
+ |
- |
+ |
+ |
+ |
- |
- |
- |
+ |
+ |
- |
- |
+ |
+ |
+ |
+ |
|
霍乱弧菌 V.cholerae |
+ |
+ |
- |
+ |
+ |
- |
V |
+ |
+ |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
|
拟态弧菌 V.mimicus |
+ |
+ |
- |
+ |
+ |
- |
- |
+ |
- |
- |
- |
- |
+ |
+ |
+ |
+ |
+ |
- |
- |
- |
|
河弧菌 V. fluvialis |
+ |
- |
+ |
- |
+ |
- |
- |
V |
+ |
+ |
- |
+ |
+ |
+ |
+ |
- |
+ |
+ |
V |
- |
|
弗氏弧菌 V.furnissii |
+ |
- |
+ |
- |
+ |
- |
- |
- |
+ |
- |
- |
+ |
+ |
+ |
+ |
- |
+ |
+ |
+ |
- |
|
梅氏弧菌 V. metschnikovii |
- |
+ |
+ |
- |
+ |
- |
+ |
V |
+ |
- |
- |
- |
+ |
+ |
+ |
- |
+ |
+ |
V |
- |
|
霍利斯弧菌 V. hollisae |
+ |
- |
- |
- |
- |
- |
- |
nd |
- |
- |
- |
+ |
+ |
- |
- |
- |
+ |
+ |
- |
- |
|
嗜水气单胞菌 A.hydrophilia |
+ |
V |
+ |
- |
+ |
- |
V |
V |
+ |
V |
V |
V |
+ |
+ |
+ |
+ |
+ |
+ |
- |
- |
|
类志贺邻单胞菌 |
+ |
+ |
+ |
+ |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
+ |
+ |
- |
- |
- |
| 注:nd 表示未试验;V 表示可变。 | ||||||||||||||||||||
6.7 PCR鉴定(选做)
6.7.1 DNA模板的制备
取可疑的纯菌落加入500 μL灭菌dH2O中混匀煮沸10 min,15000×g离心3 min。取上清液储存在-20℃直至使用。也可以用商业化的DNA提取试剂盒并按其说明提取制备DNA模板。
6.7.2 PCR扩增
6.7.2.1 引物
|
Vvh-785F |
5' ccg cgg tac agg ttg gcg ca 3' |
|
Vvh-1303R |
5' cgc cac cca ctt tcg ggc c 3' |
扩增片段长度:519 bp
6.7.2.2 阴性对照、阳性对照设置
阴性对照(空白对照)以灭菌水作为PCR反应的模板;
阳性对照采用含有检测序列的DNA(或质粒)作为PCR反应的模板。
6.7.2.3 PCR反应体系
|
试剂 |
反应体积 |
|
dH2O |
28.2 μL |
|
10× Buffer. MgCl2 |
5.0 μL |
|
dNTPs |
8.0 μL |
|
引物 |
7.5 μL |
|
模板 |
1.0 μL |
|
Taq酶 |
0.3 μL |
|
总体积 |
50.0 μL |
6.7.2.4 PCR反应程序
|
预变性 |
94℃ |
10 min; |
|
变性 |
94℃ |
1 min, |
|
退火 |
62℃ |
1 min, |
|
延伸 |
72℃ |
1 min,25个循环; |
|
终延伸 |
72℃ |
10 min; |
|
保存 |
8℃ |
—— |
6.7.2.5 电泳
用0.5×TBE制备1.5%的琼脂糖凝胶(含EB或Goldview0.5μg /mL,)。各取5 μl PCR产物点样(可包括适量上样缓冲液),用DNA分子量标记物做参照,电压100 V,电泳50 min(根据实验室仪器情况确定具体电泳条件)。使用凝胶成像系统对电泳结果进行保存和分析。
6.8 结果判定
阴性对照未出现条带,阳性对照出现预期大小的扩增条带条件下,如待测样品未出现519 bp大小的扩增条带,则可判定该样品检验结果为阴性;如待测样品出现519 bp大小的扩增条带,则可判定该样品检验结果为阳性。
如果阴性对照出现条带和/或阳性对照未出现预期大小的扩增条带,本次待测样品的结果无效,应重新进行试验,并排除污染因素。
6.9 报告
根据生化或PCR结果,报告25 g(mL)样品中检出或未检出创伤弧菌。
第二法 MPN计数法
7 操作步骤
7.1 样品制备
同6.1。
7.2 增菌
7.2.1 用灭菌吸管吸取1:10样品匀液1 mL,注入含有9 mL 3%氯化钠碱性蛋白胨水的试管内,振摇试管混匀,制备1:100的样品匀液。
7.2.2 另取1 mL灭菌吸管,按6.2.2.1操作程序,依次制备10倍系列稀释样品匀液,每递增稀释一次,换用一支1 mL无菌吸管。
7.2.3 根据对检样污染情况的估计,选择3个适宜的连续稀释度,每个稀释度接种3支含有9mL3%氯化钠碱性蛋白胨水的试管,每管接种1mL。置36℃±1℃恒温箱内,培养18 h~24 h。
7.3 分离鉴定
同定性检测。
8 结果与报告
根据证实为创伤弧菌阳性的试管管数,查最可能数(MPN)检索表,报告每g(mL)创伤弧菌的MPN值。



















搜产品