1 方法来源
GB 4789.11-2014《食品安全国家标准 食品微生物学检验β型溶血性链球菌检验》、DB46/T 280-2014《罗非鱼链球菌病检测技术规程》及文献的方法。
2 适用范围
本程序规定了淡水鱼及其养殖环境中无乳链球菌(Streptococcus agalactiae的检验方法。
3 术语和定义
3.1 β型溶血
在菌落周围形成完全透明的溶血环,红细胞完全溶解。
3.2 β型溶血性链球菌
能够产生β型溶血的化脓(或A群)链球菌(Streptococcus pyogenes)和无乳(或B群)链球菌(Streptococcus agalactiae)。
4 培养基
4.1 改良胰蛋白胨大豆肉汤(Modified tryptone soybean broth, mTSB):见附录A中A.1。
4.2 哥伦比亚CNA血琼脂(Columbia CNA blood agar):见附录A中A.2。
4.3 哥伦比亚血琼脂(Columbia blood agar):见附录A中A.3。
4.4 革兰氏染色液:见附录A中A.4。
4.5 胰蛋白胨大豆肉汤(Tryptone soybean broth, TSB):见附录A中A.5。
4.6 草酸钾血浆:见附录A中A.6。
4.7 0.25%氯化钙(CaCl2)溶液:见附录A中A.7。
4.8 3%过氧化氢(H2O2)溶液:见附录A中A.8。
第一法 无乳链球菌分离鉴定
本方法先检测疑似β型溶血性链球菌,分离出的疑似β型溶血性链球菌菌株再根据生化检测等进一步鉴定是否为无乳链球菌。
6 检验程序
无乳链球菌分离鉴定程序见图1。
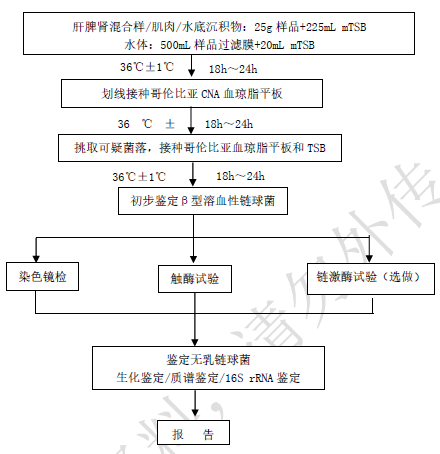
图1 无乳链球菌分离鉴定程序
7 操作步骤
7.1 样品的处理
鱼样品:鱼麻醉后,将待检鱼样放置于干净的解剖盘上,用75%酒精棉轻轻擦拭鱼体表进行消毒。用无菌剪刀和镊子取鱼的肝、脾、肾混合为一份样品,背部肌肉为另一份样品,按无菌操作分别称取检样25g,加入盛有225mL mTSB的均质袋中,用拍击式均质器均质1min~2min;或加入盛有225mL mTSB的均质杯中,以8000r/min~10000r/min均质1min~2min。
水体样品:混匀后取500mL,用0.22μm滤膜过滤,将滤膜重悬于20mL mTSB,混匀。
水底沉积物样品:去除所有表层水后,混匀取25g,加入225mL mTSB,混匀。
7.2 增菌、分离
将制备好的样品放置在36℃±1℃培养18h~24h。
将增菌液划线接种于哥伦比亚CNA血琼脂平板,36℃±1℃18h~24h,观察菌落形态。
β溶血性链球菌在哥伦比亚CNA血琼脂平板上的典型菌落形态为直径约2mm~3mm,灰白色、表面光滑突起、有乳光、圆形、边缘整齐,并产生β溶血的菌落。注意部分菌株无β溶血环。
7.3 纯培养
挑取5个(如小于5个则全选)可疑菌落分别接种哥伦比亚血琼脂平板和TSB增菌液,36℃±1℃培养18h~24h。
7.4 初步鉴定β型溶血性链球菌
7.4.1 革兰氏染色镜检
挑取可疑菌落染色镜检。β型溶血性链球菌为革兰氏染色阳性,球形或卵圆形,常排列成短链状。
7.4.2 触酶试验
挑取可疑菌落于洁净的载玻片上,滴加适量3%过氧化氢(H2O2)溶液,立即产生气泡者为阳性。β型溶血性链球菌触酶试验为阴性。
7.4.3 链激酶试验(选做)
吸取草酸钾血浆0.2mL于0.8mL灭菌生理盐水中混匀,再加入经36℃±1℃培养18h~24h的可疑菌的TSB培养液0.5mL及0.25%氯化钙(CaCl2)0.25mL,振荡摇匀,置于36℃±1℃水浴中10min,血浆混合物自行凝固(凝固程度至试管倒置,内容物不流动)。继续36℃±1℃培养24h,凝固块重新完全溶解为阳性,不溶解为阴性,β型溶血性链球菌为阳性。
7.5 鉴定无乳链球菌
根据7.4结果符合β型溶血性链球菌特征的菌株可采用下列任一种方法进一步确定是否为无乳链球菌。
7.5.1 生化鉴定
采用生化鉴定试剂盒或生化鉴定卡,如API 20 STREP或VITEK鉴定卡进一步确定是否为无乳链球菌。
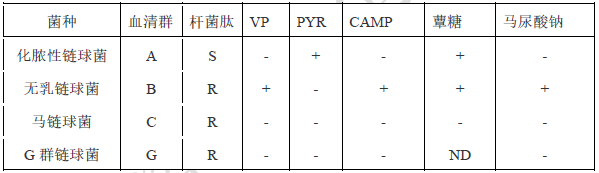
7.5.1.1 无乳链球菌部分生化试验:触酶试验阴性,分解海藻糖,不分解山梨醇,马尿酸钠、CAMP和VP试验均为阳性,七叶苷和6.5%NaCl试验均为阴性。
7.5.1.2 无乳链球菌传统生化鉴别要点:
1)本菌特征革兰阳性球菌,菌落较小,β溶血环、触酶试验阴性,CAMP试验阳性。
2)与其他溶血链球菌的鉴别
附录A培养基和试剂
A.1 改良胰蛋白胨大豆肉汤培养基(Modified tryptone soybean broth, mTSB)
A.1.1 基础培养基(胰蛋白胨大豆肉汤TSB)
A.1.1.1 成分
A.1.1.2 制法
胰蛋白胨
17.0g
大豆蛋白胨
3.0g
氯化钠
5.0g
磷酸二氢钾(无水)
2.5g
葡萄糖
2.5g
蒸馏水
1000.0mL
将A.1.1.1中各成分溶于蒸馏水中,加热溶解,校正pH至7.3±0.2,121 ℃灭菌15min,备用。
A.1.2 抗生素溶液
A.1.2.1 多黏菌素溶液
称取10mg多黏菌素B于10mL灭菌蒸馏水中,振摇混匀,充分溶解后过滤除菌。
A.1.2.2 萘啶酮酸钠溶液
称取10 mg萘啶酮酸于10mL 0.05mol/L氢氧化钠溶液中,振摇混匀,充分溶解后过滤除菌。
A.1.3 完全培养基
A.1.3.1 成分
A.1.3.2 制法
胰蛋白胨大豆肉汤(TSB)
1000.0mL
多黏菌素溶液
10.0mL
萘啶酮酸钠溶液
10.0mL
无菌条件下,将A.1.3.1中各成分进行混合,充分混匀,分装备用。
相关产品:
A.2 哥伦比亚CNA血琼脂(Columbia CNA blood agar)
A.2.1 成分
A.2.2 制法
胰酪蛋白胨
12.0g
动物组织蛋白消化液
5.0g
酵母提取物
3.0g
牛肉提取物
3.0g
玉米淀粉
1.0g
氯化钠
5.0g
琼脂
13.5g
多黏菌素
0.01g
萘啶酸
0.01g
蒸馏水
1000.0mL
将A.2.1中各成分溶于蒸馏水中,加热溶解,校正pH至7.3±0.2,121 ℃灭菌12min,待冷却至50℃左右时加50mL;无菌脱纤维绵羊血,摇匀后倒平板。
相关产品:
A.3 哥伦比亚血琼脂(Columbia blood agar)
A.3.1 基础培养基
A.3.1.1 成分
A.3.1.2 制法
动物组织酶解物
23.0g
淀粉
1.0g
氯化钠
5.0g
琼脂
8.0g~18.0g
蒸馏水
1000.0mL
将基础培养基成分溶解于蒸馏水中,加热促其溶解。121℃高压灭菌15min。
A.3.2 无菌脱纤维绵羊血
无菌操作条件下,将绵羊血加入到盛有灭菌玻璃珠的容器中,振摇约10min,静置后除去附有血纤维的玻璃珠即可。
A.3.3 完全培养基
A.3.3.1 组分
A.3.3.2 制法
基础培养基
1000.0mL
无菌脱纤维绵羊血
50.0mL
当基础培养基的温度为45℃左右时,无菌加入绵羊血,混匀。校正pH至7.2±0.2。倾注15mL于无菌平皿中,静置至培养基凝固。使用前需预先干燥平板。预先制备的平板未干燥时在室温放置不得超过4h,或在4℃冷藏不得超过7d。
相关产品:
A.4 革兰氏染色液
A.4.1 结晶紫染色液基础培养基
A.4.1.1 成分
A.4.1.2 制法
结晶紫
1.0g
95%乙醇
20.0mL
1%草酸铵水溶液
80.0mL
将结晶紫完全溶解于乙醇中,然后与草酸铵溶液混合。
A.4.2 革兰氏碘液
A.4.2.1 成分
A.4.2.2 制法
碘
1.0g
碘化钾
2.0g
蒸馏水
300.0mL
将碘与碘化钾先进行混合,加入蒸馏水少许充分振摇,待完全溶解后,再加蒸馏水至300mL。
A.4.3 沙黄复染液
A.4.3.1 成分
A.4.3.2 制法
沙黄
0.25g
95%乙醇
10.0mL
蒸馏水
90.0mL
将沙黄溶解于乙醇中,然后用蒸馏水稀释。
A.4.4 染色操作步骤
将涂片在酒精灯火焰上固定,滴加结晶紫染色液,染1min,水洗;滴加革兰氏碘液,作用1min,水洗;滴加95%乙醇脱色,约15s~30s,直至染色液被洗掉,不要过分脱色,水洗;滴加复染液,复染1min,水洗后进行干燥,镜检。
相关产品:
A.5 胰蛋白胨大豆肉汤Tryptone soybean broth, TSB
A.5.1 成分
A.5.2 制法
胰蛋白胨
17.0g
氯化钠
5.0g
大豆蛋白胨
3.0g
磷酸二氢钾(无水)
2.5g
葡萄糖
2.5g
蒸馏水
1000.0mL
将A.5.1中各成分溶于蒸馏水中,加热溶解,校正pH至7.3±0.2,121℃灭菌15min,分装备用。
相关产品:
A.6 草酸钾血浆
A.6.1 成分
A.6.2 制法
草酸钾
0.01g
人血
5.0mL
草酸钾0.01g放入灭菌小试管中,再加入5mL人血,混匀,经离心沉淀,吸取上清液即为草酸钾血浆。
相关产品:
A.7 0.25%氯化钙(CaCl2)溶液
A.7.1 成分
A.7.2 制法
氯化钙(无水)
22.2g
蒸馏水
1000.0mL
称取22.2g氯化钙(无水)溶于蒸馏水中,分装备用。
相关产品:
A.8 3%过氧化氢(H2O2)溶液
A.8.1 成分
A.8.2 制法
30%过氧化氢(H2O2)溶液
100.0mL
蒸馏水
900.0mL
吸取100mL 30%过氧化氢(H2O2)溶液,溶于蒸馏水中,混匀,分装备用。
相关产品:



















搜产品