一、平板计数法的介绍
现中国药典对培养基灵敏度的检查方法采用的是变色单位试验法(CCU法),即是将肺炎支原体ATCC 15531、口腔支原体ATCC 23714分别接种至支原体肉汤、精氨酸支原体肉汤中,于36℃±1℃培养至培养基变色,盲传两代后,将培养物接种至待检培养基中,做10倍系列稀释,肺炎支原体稀释至10-7~10-9,接种在支原体肉汤培养基内;口腔支原体稀释至10-3~10-5,接种在精氨酸支原体肉汤培养基内。每个稀释度接种3支试管,置36℃±1℃培养7d~14d,观察培养基变色结果。
美国药典已舍弃了变色单位试验法,现使用的是平板计数法(CFU法),即是向100mL液体培养基和至少9 mL固体培养基中接入不超过100CFU的支原体,接种的支原体至少包含一株葡萄糖发酵型菌株(肺炎支原体或等效菌株)以及一株精氨酸水解型菌株(口腔支原体),液体培养基于36℃±1℃密闭容器中培养,固体培养基于36℃±1℃、5%~10% CO2、湿润环境中培养。
对比CCU和CFU法,显然CFU法对支原体的培养要求更为苛刻。采用CFU法,可更直观的观察支原体的菌落形态,也可对支原体的菌数进行计算。
二、肺炎支原体、口腔支原体检验依据
人肺炎支原体、猪肺炎支原体、口腔支原体液体培养的试验方法依据于2020年版《中华人民共和国药典》,以上支原体固体平板培养的试验方法依据于《美国药典》。以上支原体固体平板培养的方法以及染色方法可参考文章《人肺炎支原体、猪肺炎支原体、口腔支原体固体平板法及染色镜检》-点击查看,这里不再叙述。
人肺炎支原体、猪肺炎支原体固体平板计数用培养基推荐如表1所示,不同点在于,人肺炎支原体培养应搭配马血清或牛血清使用,猪肺炎支原体培养应搭配猪血清使用。
表1 肺炎支原体固体平板计数法推荐用培养基
|
培养基种类
|
品名 |
货号 |
使用方法 |
|
即用型平板
|
肺炎支原体固体培养基平板 |
HBPM055 |
直接取用 |
|
琼脂培养基
|
支原体琼脂培养基 |
HB7025-3 |
高压灭菌后倒板使用 |
|
肉汤培养基
|
支原体肉汤培养基 |
HB7025-2 |
添加琼脂后灭菌倒板使用,琼脂用量为10g/L |
|
脑心浸液肉汤(BHI)(疫苗专用) |
HB8297-81 |
口腔支原体固体平板计数用培养基如表2所示,口腔支原体应搭配马血清或牛血清使用。
表2 口腔支原体固体平板计数法推荐用培养基
培养基种类
品名
货号
使用方法
琼脂培养基
支原体琼脂培养基(含精氨酸)
HB7025-1
高压灭菌后倒板使用
肉汤培养基
精氨酸支原体肉汤培养基
HB7025-5
添加琼脂后灭菌倒板使用,琼脂用量为10g/L
三、试验方法
本次肺炎支原体、口腔支原体固体平板计数法使用的培养基分别是BHI、精氨酸支原体肉汤。
平板的配制方法参考文章《猪肺炎支原体在固体平板上的培养方法及染色镜检》,这里不再叙述。使用BHI疫苗专用培养基肉汤、精氨酸支原体肉汤作为稀释液,将肺炎支原体、口腔支原体原液梯度稀释至10-9。
人肺炎支原体固体平板计数法:吸取人肺炎支原体原液10-1~10-5稀释液共六个浓度分别涂布至BHI琼脂平板,涂布量为100 μL,10-1~10-9稀释液与固体平板均放置于36℃±1℃培养箱中培养,培养7d~21d。这里应注意,有条件的,需将平板置于5%~10%二氧化碳培养箱中正置培养,同时保持湿润环境,没有条件的,需使用封口膜对平板缝隙处进行封膜处理。
猪肺炎支原体固体平板计数法:吸取猪肺炎支原体原液10-1~10-5稀释液共六个浓度分别涂布至BHI琼脂平板,涂布量为40μL(特制平板涂布量少较佳),10-1~10-9稀释液与固体平板均放置于36℃±1℃培养箱中培养,培养7d~21d。这里同人肺炎支原体固体平板培养的注意事项,此外,猪肺炎支原体较人肺炎支原体对潮湿环境的要求更高。
口腔支原体固体平板计数法:吸取口腔支原体原液10-1~10-5稀释液共六个浓度分别涂布至精氨酸支原体琼脂平板,涂布量为100μL,10-1~10-9稀释液与固体平板均放置于36℃±1℃培养箱中培养,培养7d~14d即可。口腔支原体较肺炎支原体易于培养。
四、人肺炎支原体计数结果
如图1所示,培养至13d时,人肺炎支原体稀释液10-1~10-8稀释管变至黄色。

图1 人肺炎支原体稀释液培养至13d
培养至7d时,人肺炎支原体高浓度涂布平板可见支原体菌落,持续培养至17d时,低浓度平板上可见支原体菌落,10-1~10-4涂布平板如图2所示。为更好的展示菌落形态,截取平皿表面局部的菌落,此外,低浓度涂布平板表面上的菌落不易拍照,需对光拍照。

10-1 10-2

10-3 10-4
图2 人肺炎支原体在固体平板上涂布的结果
由图2可知,10-4涂布平板表面单菌落清晰可见(肉眼观察较图片更为清晰),可进行精确计数,10-4平板表面菌落均数为230个(应注意图片为平板表面局部图,并非展示了所有菌落),该菌数是由10-4稀释液涂布100μL菌液得到的,由于稀释液体系为10mL,则可推算1mL原液菌数为2.3×107CFU人肺炎支原体,则10-8稀释液理论接入了约2CFU人肺炎支原体,10-9稀释液未有菌接入,结合图1可知,添加约2CFU人肺炎支原体可使支原体肉汤培养至13d时有颜色变化。
应注意的是,由于梯度稀释存在一定的误差,若振荡不均匀,可能导致10-8稀释管未有菌接入,结果即是无论延长培养多少天,10-8稀释管均不会发生变色;误差也可能导致10-9接入了菌,结果即是延长培养一定天数后,10-9稀释管也会发生颜色变化。
为验证该菌落为人肺炎支原体,对该菌落进行染色,染色镜检图片如图3所示。
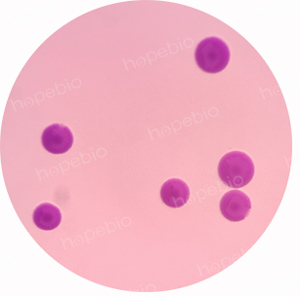
图3 人肺炎支原体染色镜检
五、猪肺炎支原体计数结果
如图4所示,培养至12d时,猪肺炎支原体稀释液10-1~10-9稀释管变至黄色。

图4 猪肺炎支原体稀释液培养至12d
培养至7d时,猪肺炎支原体高浓度涂布平板可见支原体菌落,持续培养至14d时,低浓度平板上可见支原体菌落,10-2~10-5涂布平板如图5所示。为更好的展示菌落形态,截取平皿表面局部的菌落,此外,低浓度涂布平板表面上的菌落不易拍照,需对光拍照。

10-2 10-3
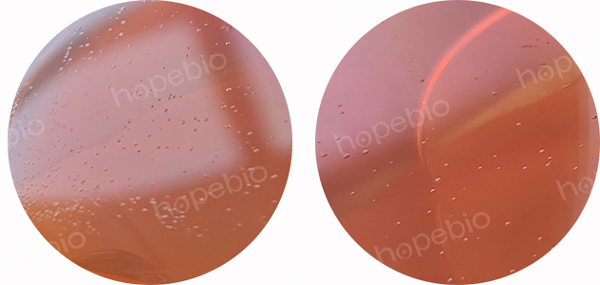
10-4 10-5
图5 猪肺炎支原体在固体平板上涂布的结果
由图5可知,10-5涂布平板表面单菌落清晰可见(肉眼观察较图片更为清晰),可进行精确计数,10-5平板表面菌落均数为140个(应注意图片为平板表面局部图,并非展示了所有菌落),该菌数是由10-5稀释液涂布40μL菌液得到的,由于稀释液体系为10mL,则可推算1mL原液菌数为3.5×108CFU猪肺炎支原体,则10-9稀释液理论接入了约4CFU猪肺炎支原体,结合图4可知,添加约4CFU猪肺炎支原体可使支原体肉汤培养至12d时有颜色变化。
为验证该菌落为猪肺炎支原体,对该菌落进行染色,染色镜检图片如图6所示。
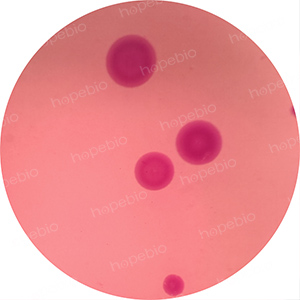
图6 猪肺炎支原体染色镜检
六、口腔支原体计数结果
如图7所示,培养至8d时,口腔支原体稀释液10-1~10-7稀释管变至粉红,延长培养至12d时,10-8稀释管也变至粉红。
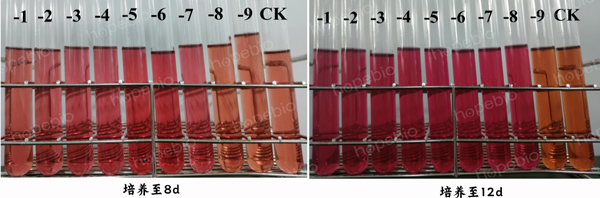
图7 口腔支原体稀释液分别培养至8、12d
培养至3d~5d,口腔支原体高浓度涂布平板可见支原体菌落,持续培养至8d时,低浓度平板上可见支原体菌落,10-1~10-4涂布平板如图8所示。为更好的展示菌落形态,截取平皿表面局部的菌落。

10-1 10-2

10-3 10-4
图8口腔支原体在固体平板上涂布的结果
由图8可知,10-4涂布平板表面单菌落清晰可见(肉眼观察较图片更为清晰),可进行精确计数,10-4平板表面菌落均数为172个(应注意图片为平板表面局部图,并非展示了所有菌落),该菌数是由10-4稀释液涂布100μL菌液得到的,由于稀释液体系为10mL,则可推算1mL原液菌数为1.72×107CFU口腔支原体,则10-8稀释液理论接入了约2CFU口腔支原体,添加17CFU口腔支原体可使精氨酸支原体肉汤培养至8d时有颜色变化,添加约2CFU口腔支原体可使精氨酸支原体肉汤培养至12d时有颜色变化。
若培养相同时间,口腔支原体较肺炎支原体菌落要大许多,将10-4稀释浓度涂布的平板延长培养至14d,口腔支原体的菌落状态如图9所示。

图9 延长培养至14d的平板表面的口腔支原体
为验证该菌落为口腔支原体,对该菌落进行染色,染色镜检图片如图10所示。
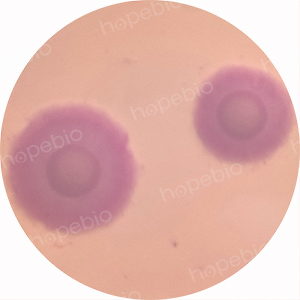
图10 口腔支原体染色镜检
注:本文属海博生物原创,未经允许不得转载。



















搜产品