控制菌检查法系用于在规定的试验条件下,检查供试品中是否存在特定的微生物。
当本法用于检查非无菌制剂及其原、辅料是否符合相应的微生物限度标准时,应按下列规定进行检验,包括样品取样量和结果判断等。
本检查法可采用替代的微生物检查法,包括自动检测方法,但必须证明替代方法等效于药典规定的检查方法。
供试液制备及实验环境要求同“非无菌产品微生物限度检查:微生物计数法”(通则1105)。
如果供试品具有抗菌活性,应尽可能去除或中和。供试品检查时, 若使用了中和剂或灭活剂,应确认有效性及对微生物无毒性。
供试液制备时如果使用了表面活性剂,应确认其对微生物无毒性以及与所使用中和剂或灭活剂的相容性。
培养基适用性检查和控制菌检查方法适用性试验
供试品控制菌检查中所使用的培养基应进行适用性检查。
供试品的控制菌检查方法应进行方法适用性试验,以确认所采用的方法适合于该产品的控制菌检查。
若检验程序或产品发生变化可能影响检验结果时,控制菌检查方法应重新进行适用性试验。
菌种及菌液制备
菌种 试验用菌株的传代次数不得超过5 代(从菌种保藏中心获得的干燥菌种为第0 代),并采用适宜的菌种保藏技术进行保存,以保证试验菌株的生物学特性。
金黄色葡萄球菌(Staphylococcus aureus)〔CMCC(B)26 003〕
铜绿假单胞菌(Pseudomonas aeruginosa)〔CMCC(B)10 104〕
大肠埃希菌(Escherichia coli)〔CMCC(B)44 102〕
乙型副伤寒沙门菌(Salmonella paratyphi B)〔CMCC(B)50 094〕
白色念珠菌(Candida albicans)〔CMCC(F)98 001〕
生孢梭菌(Clostridium sporogenes)〔CMCC(B)64 941〕
菌液制备 将金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、沙门菌分别接种于胰酪大豆胨液体培养基中或在胰酪大豆胨琼脂培养基上,30~35℃培养18~24 小时;将白色念珠菌接种于沙氏葡萄糖琼脂培养基上或沙氏葡萄糖液体培养基中,20~25℃培养2~3 天;将生孢梭菌接种于梭菌增菌培养基中置厌氧条件下30~35℃培养24~48 小时或接种于硫乙醇酸盐流体培养基中30~35℃培养18~24 小时。上述培养物用pH7.0 无菌氯化钠-蛋白胨缓冲液或0.9%无菌氯化钠溶液制成适宜浓度的菌悬液。
菌液制备后若在室温下放置,应在2 小时内使用;若保存在2~8℃,可在24 小时内使用。生孢梭菌孢子悬液可替代新鲜的菌悬液,稳定的孢子悬液可保存在2~8℃,在验证过的贮存期内使用。
阴性对照
为确认试验条件是否符合要求,应进行阴性对照试验, 阴性对照试验应无菌生长。如阴性对照有菌生长,应进行偏差调查。
培养基适用性检查
控制菌检查用的成品培养基、由脱水培养基或按处方配制的培养基均应进行培养基的适用性检查。
控制菌检查用培养基的适用性检查项目包括促生长能力、抑制能力及指示特性的检查。各培养基的检测项目及所用的菌株见表1。
表1 控制菌检查用培养基的促生长能力、抑制能力和指示特性
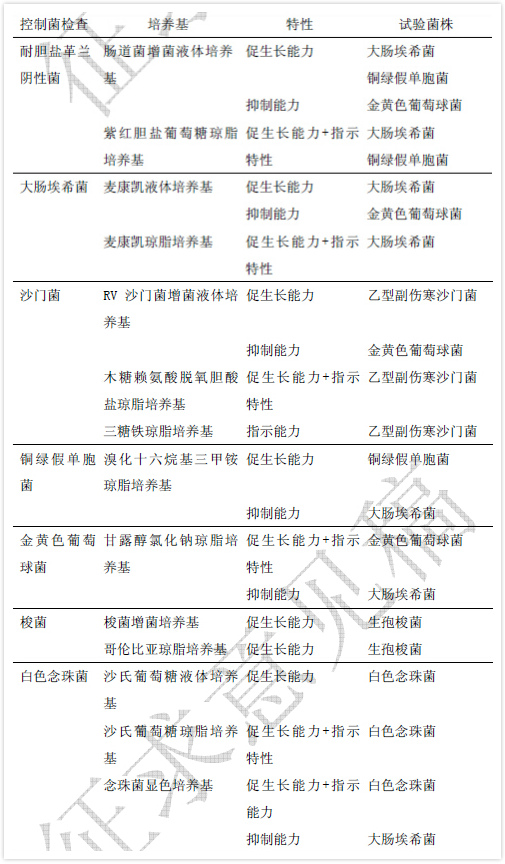
液体培养基促生长能力检查 分别接种不大于100cfu 的试验菌(见表1)于被检培养基和对照培养基中,在相应控制菌检查规定的培养温度及不长于规定的最短培养时间下培养,与对照培养基管比较,被检培养基管试验菌应生长良好。
固体培养基促生长能力检查 用涂布法分别接种不大于100cfu 的试验菌(见表1)于被检培养基和对照培养基平板上,在相应控制菌检查规定的培养温度及不长于规定的最短培养时间下培养,被检培养基与对照培养基上生长的菌落大小、形态特征应一致。
培养基抑制能力检查 接种不少于100cfu 的试验菌(见表1)于被检培养基和对照培养基中,在相应控制菌检查规定的培养温度及不短于规定的最长培养时间下培养,试验菌应不得生长。
培养基指示特性检查 用涂布法分别接种不大于100cfu 的试验菌(见表1)于被检培养基和对照培养基平板上,在相应控制菌检查规定的培养温度及不长于规定的最短培养时间下培养,被检培养基上试验菌生长的菌落大小、形态特征、指示剂反应情况等应与对照培养基一致。
控制菌检查方法适用性试验
供试液制备 按下列“供试品检查”中的规定制备供试液。
试验菌 根据各品种项下微生物限度标准中规定检查的控制菌选择相应试验菌株,确认耐胆盐革兰阴性菌检查方法时,采用大肠埃希菌和铜绿假单胞菌为试验菌。
适用性试验 按控制菌检查法取规定量供试液及不大于100cfu 的试验菌接入规定的培养基中;采用薄膜过滤法时,取规定量供试液,过滤,冲洗,试验菌应加在最后一次冲洗液中,过滤后,注入规定的培养基或取出滤膜接入规定的培养基中。依相应的控制菌检查方法,在规定的温度及最短时间下培养,应能检出所加试验菌相应的反应特征。
结果判断 上述试验若检出试验菌,按此供试液制备法和控制菌检查方法进行供试品检查;若未检出试验菌,应消除供试品的抑菌活性(见非无菌产品微生物检查:微生物计数法(附录×××)中的“抗菌活性的去除或灭活”),并重新进行方法适用性试验。
如果经过试验确证供试品对试验菌的抗菌作用无法消除,可认为受抑制的微生物不可能存在于该供试品中,选择抑菌成份消除相对彻底的方法进行供试品的检查。
供试品检查
供试品的控制菌检查应按经方法适用性试验确认的方法进行。
阳性对照试验 阳性对照试验方法同供试品的控制菌检查,对照菌的加量应不大于100cfu。阳性对照试验应检出相应的控制菌。
阴性对照试验 以稀释剂代替供试液照相应控制菌检查法检查,阴性对照试验应无菌生长。如果阴性对照有菌生长,应进行偏差调查。
耐胆盐革兰阴性菌(Bile-Tolerant Gram-Negative Bacteria)
供试液制备和预培养 取供试品,用胰酪大豆胨液体作为稀释剂照“非无菌产品微生物限度检查:微生物计数法” (通则1105)制成1:10 供试液,混匀,在20~25℃培养,培养时间应使供试品中的细菌充分恢复但不增殖(约2 小时)。
未检出试验
除另有规定外,取相当于1g 或1mL 供试品的上述预培养物接种至肠道菌增菌液体培养基中,30~35℃培养24~48 小时后,划线接种于紫红胆盐葡萄糖琼脂培养基平板上,30~35℃培养18~24 小时。如果平板上无菌落生长,判供试品未检出耐胆盐革兰阴性菌。
定量试验
选择和分离培养 取相当于0.1g、0.01g 和0.001g(或0.1mL、0.01mL 和0.001mL)供试品的预培养物或其稀释液分别接种至肠道菌增菌液体培养基中,30~35℃培养24~48 小时。上述每一培养物分别划线接种于紫红胆盐葡萄糖琼脂培养基平板上,30~35℃培养18~24 小时。
结果判断 若紫红胆盐葡萄糖琼脂培养基平板上有菌落生长,则对应培养管为阳性,否则为阴性。根据各培养管检查结果,从表2 查对1g 或1ml 供试品中含有耐胆盐革兰阴性菌的最大可能数。
表2 耐胆盐革兰阴性菌的可能菌数

注:⑴ +代表紫红胆盐葡萄糖琼脂平板上有菌落生长;-代表紫红胆盐葡萄糖琼脂平板上无菌落生长。
⑵ 若供试品量减少10 倍(如0.01g 或0.01ml,0.001g 或0.001ml,0.0001g 或0.0001ml),则每1g(或1mL)供试品中可能的菌数(N)应相应增加10 倍。
大肠埃希菌(Escherichia coli)
供试液制备和增菌培养 取供试品,照“非无菌产品微生物限度检查:微生物计数法” (通则1105)制成1:10 供试液。取相当于1g 或1mL 供试品的供试液,接种至适宜体积(经方法适用性试验确定的)的胰酪大豆胨液体培养基中,混匀,30~35℃培养18~24 小时。
选择和分离培养 取上述预培养物1mL 接种至100mL 麦康凯液体培养基中,42~44℃培养24~48 小时。取麦康凯液体培养物划线接种于麦康凯琼脂培养基平板上,30~35℃培养18~72 小时。
结果判断 若麦康凯琼脂培养基平板上有菌落生长,应进行分离、纯化及适宜的鉴定试验, 确证是否为大肠埃希菌;若麦康凯琼脂培养基平板上没有菌落生长,或虽有菌落生长但鉴定结果为阴性,判供试品未检出大肠埃希菌。
沙门菌(Salmonella)
供试液制备和增菌培养 取10g 或10mL 供试品直接或处理后接种至适宜体积(经方法适用性试验确定的)的胰酪大豆胨液体培养基中,混匀,30~35℃培养18~24 小时。
选择和分离培养 取上述预培养物0.1mL 接种至10mL RV 沙门增菌液体培养基中,30~35℃培养18~24 小时。取少量RV 沙门菌增菌液体培养物划线接种于木糖赖氨酸脱氧胆酸盐琼脂培养基平板上,30~35℃培养18~48 小时。
沙门菌在木糖赖氨酸脱氧胆酸盐琼脂培养基平板上生长良好,菌落为淡红色或无色、透明或半透明、中心有或无黑色。用接种针挑选疑似菌落于三糖铁琼脂培养基高层斜面上进行斜面和高层穿刺接种,培养18~24 小时,或采用其它适宜方法进一步鉴定。
结果判断 若木糖赖氨酸脱氧胆酸盐琼脂培养基平板上有疑似菌落生长,且三糖铁琼脂培养基的斜面为红色、底层为黄色,或斜面黄色、底层黄色或黑色,应进一步进行适宜的鉴定试验, 确证是否为沙门菌。如果平板上没有菌落生长,或虽有菌落生长但鉴定结果为阴性,或三糖铁琼脂培养基的斜面未见红色、底层未见黄色;或斜面黄色、底层未见黄色黑色,判供试品未检出沙门菌。
铜绿假单胞菌(Pseudomonas aeruginosa)
供试液制备和增菌培养 取供试品,照“非无菌产品微生物限度检查:微生物计数法” (通则1105)制成1:10 供试液。取相当于1g 或1mL 供试品的供试液,接种至适宜体积(经方法适用性试验确定的)的胰酪大豆胨液体培养基中,混匀。30~35℃培养18~24 小时。
选择和分离培养 取上述预培养物划线接种于溴化十六烷基三甲铵琼脂培养基平板上,30~35℃培养18~72 小时。
取上述平板上生长的菌落进行氧化酶试验,或采用其它适宜方法进一步鉴定。
氧化酶试验 将洁净滤纸片置于平皿内,用无菌玻棒取上述平板上生长的菌落涂于滤纸片上,滴加新配制的1%二盐酸二甲基对苯二胺试液,在30 秒内若培养物呈粉红色并逐渐变为紫红色为氧化酶试验阳性,否则为阴性。
结果判断 若溴化十六烷基三甲铵琼脂培养基平板上有菌落生长,且氧化酶试验阳性,应进一步进行适宜的鉴定试验, 确证是否为铜绿假单胞菌。如果平板上没有菌落生长,或虽有菌落生长但鉴定结果为阴性,或氧化酶试验阴性,判供试品未检出铜绿假单胞菌。
金黄色葡萄球菌(Staphylococcus aureus)
供试液制备和增菌培养 取供试品,照“非无菌产品微生物限度检查:微生物计数法” (通则1105)制成1:10 供试液。取相当于1g 或1mL 供试品的供试液,接种至适宜体积(经方法适用性试验确定的)的胰酪大豆胨液体培养基中,混匀。30~35℃培养18~24 小时。
选择和分离培养 取上述预培养物划线接种于甘露醇氯化钠琼脂培养基平板上,30~35℃培养18~72 小时。
结果判断 若甘露醇氯化钠琼脂培养基平板上有黄色菌落或外周有黄色环的白色菌落生长,应进行分离、纯化及适宜的鉴定试验, 确证是否为金黄色葡萄球菌;若平板上没有与上述形态特征相符或疑似的菌落生长,或虽有相符或疑似的菌落生长但鉴定结果为阴性,判供试品未检出金黄色葡萄球菌。
梭菌(Clostridia)
供试液制备和热处理 取供试品,照“非无菌产品微生物限度检查:微生物计数法” (通则1105)制成1:10 供试液。取相当于1g 或1mL 供试品的供试液2 份,其中1 份置80℃保温10 分钟后迅速冷却。
选择和分离培养 将上述2 份供试液分别接种至适宜体积(经方法适用性试验确定的)的梭菌增菌培养基中,置厌氧条件下30~35℃培养48 小时。取上述每一培养物少量,分别涂抹接种于哥伦比亚琼脂培养基平板上,置厌氧条件下30~35℃培养48~72 小时。
过氧化氢酶试验 取上述平板上生长的菌落,置洁净玻片上,滴加3%过氧化氢试液,若菌落表面有气泡产生,为过氧化氢酶试验阳性,否则为阴性。
结果判断 若哥伦比亚琼脂培养基平板上有带或不带芽孢的厌氧杆菌生长,且过氧化氢酶反应阴性的,应进一步进行适宜的鉴定试验, 确证是否为梭菌;如果哥伦比亚琼脂培养基平板上没有厌氧杆菌生长,或虽有相符或疑似的菌落生长但鉴定结果为阴性,或过氧化氢酶反应阳性,判供试品未检出梭菌。
白色念珠菌(Candida albicans)
供试液制备和增菌培养 取供试品,照“非无菌产品微生物限度检查:微生物计数法” (通则1105)制成1:10 供试液。取相当于1g 或1mL 供试品的供试液,接种到100mL 沙氏葡萄糖液体培养基中,混匀,30~35℃培养3~5 天。
选择和分离 取上述预培养物划线接种于沙氏葡萄糖琼脂培养基平板上,30~35℃培养24~48 小时。
白色念珠菌在沙氏葡萄糖琼脂培养基上生长的菌落呈乳白色,偶见淡黄色,表面光滑有浓酵母气味,培养时间稍久则菌落增大,颜色变深、质地变硬或有皱褶。挑取疑似菌落接种至念珠菌显色培养基平板上,培养24~48 小时(必要时延长至72 小时),或采用其它适宜方法进一步鉴定。
结果判断 若沙氏葡萄糖琼脂培养基平板上有疑似菌落生长,且疑似菌在念珠菌显色培养基平板上生长的菌落阳性反应,应进一步进行适宜的鉴定试验, 确证是否为白色念珠菌;若沙氏葡萄糖琼脂培养基平板上没有菌落生长,或虽有菌落生长但鉴定结果为阴性,或疑似菌在念珠菌显色培养基平板上生长的菌落呈阴性反应,判供试品未检出白色念珠菌。
稀释液
稀释液配制后,应采用验证合格的灭菌程序灭菌。
1. pH7.0 无菌氯化钠-蛋白胨缓冲液 照无菌检查法(通则1101)制备。
2. pH6.8 无菌磷酸盐缓冲液、pH7.2 无菌磷酸盐缓冲液 、pH7.6 无菌磷酸盐缓冲液按缓冲液 照缓冲液(通则8004)配制后,过滤,分装,灭菌。
如需要,可在上述稀释液灭菌前或灭菌后加入表面活性剂或中和剂等。
3. 0.9%无菌氯化钠溶液 取氯化钠9.0g,加水溶解使成1000ml,过滤,分装,灭菌。
培养基及其制备方法
培养基可按以下处方制备,也可使用按该处方生产的符合要求的脱水培养基。配制后,应按验证过的高压灭菌程序灭菌。
1.胰酪大豆胨液体培养基(TSB)、胰酪大豆胨琼脂培养基(TSA)、沙氏葡萄糖液体培养基(SDB) 照无菌检查法(通则1101)制备。
照无菌检查法(通则1101)制备。如使用含抗生素的沙氏葡萄糖琼脂培养基,应确认培养基中所加的抗生素量不影响检品中霉菌和酵母菌的生长。
马铃薯(去皮) 200g 琼脂 14.0g
葡萄糖 20.0g 纯化水 1000mL
取马铃薯,切成小块,加水1000mL,煮沸20-30min,用6-8 层纱布过滤,取滤液补水至1000ml,调节pH 值使灭菌后在25℃的pH 值为5.6±0.2,加入琼脂,加热溶化后, 再加入葡萄糖,摇匀,分装,灭菌。
胨 5.0g 玫瑰红钠 0.0133g
葡萄糖 10.0g 琼脂 14.0g
磷酸二氢钾 1.0g 纯化水 1000ml
硫酸镁 0.5g
除葡萄糖、玫瑰红钠外,取上述成分,混合,微温溶解,加入葡萄糖、玫瑰红钠,摇匀,分装,灭菌。
5、硫乙醇酸盐流体培养基 照无菌检查法(通则1101)制备
明胶胰酶水解物 10.0g 二水合磷酸氢二钠 8.0g
牛胆盐 20.0g 亮绿 15mg
葡萄糖 5.0g 纯化水 1000mL
磷酸二氢钾 2.0g
除葡萄糖、亮绿外,取上述成分,混合,微温溶解,调节pH 值使加热后在25℃的pH 值为7.2±0.2,加入葡萄糖、亮绿,加热至100℃ 30 分钟,立即冷却。
酵母浸出粉 3.0g 中性红 30mg
明胶胰酶水解物 7.0g 结晶紫 2mg
脱氧胆酸钠 1.5g 琼脂 15.0g
葡萄糖 10.0g 纯化水 1000mL
氯化钠 5.0g
除葡萄糖、中性红、结晶紫、琼脂外,取上述成分,混合,微温溶解,调节pH使加热后在25℃的pH 值为7.4±0.2。加入葡萄糖、中性红、结晶紫、琼脂,加热煮沸(不能在高压灭菌器中加热)。
8、麦康凯液体培养基
明胶胰酶水解物 20.0g 溴甲酚紫 10mg
乳糖 10.0g 纯化水 1000mL
牛胆盐 5.0g
除乳糖、溴甲酚紫外,取上述成分,混合,微温溶解,调节pH 值使灭菌后在25℃的pH 值为7.3±0.2,加入乳糖、溴甲酚紫,分装,灭菌。
9、麦康凯琼脂培养基
明胶胰酶水解物 17.0g 中性红 30.0mg
胨(肉或酪蛋白) 3.0g 结晶紫 1mg
乳糖 10.0g 琼脂 13.5g
脱氧胆酸钠 1.5g 纯化水 1000mL
氯化钠 5.0g
除乳糖、中性红、结晶紫、琼脂外,取上述成分,混合,微温溶解,调节pH值使灭菌后在25℃的pH 值为7.1±0.2,加入乳糖、中性红、结晶紫、琼脂,加热煮沸1 分钟,并不断振摇,分装,灭菌。
大豆胨 4.5g 六水合氯化镁 29.0g
氯化钠 8.0g 孔雀绿 36mg
磷酸氢二钾 0.4g 纯化水 1000mL
磷酸二氢钾 0.6g
除孔雀绿外,取上述成分,混合,微温溶解,调节pH 值使灭菌后在25℃的pH 值为5.2±0.2。加入孔雀绿,分装,灭菌,灭菌温度不能超过115℃。
酵母浸出粉 3.0g 氯化钠 5.0g
L-赖氨酸 5.0g 硫代硫酸钠 6.8g
木糖 3.5g 枸橼酸铁铵 0.8g
乳糖 7.5g 酚红 80mg
蔗糖 7.5g 琼脂 13.5g
脱氧胆酸钠 2.5g 纯化水 1000mL
除三种糖、酚红、琼脂外,取上述成分,混合,微温溶解,调节pH 值使加热后在25℃的pH 值为7.4±0.2,加入三种糖、酚红、琼脂,加热至沸腾,冷至50℃倾注平皿(不能在高压灭菌器中加热)。
胨 20.0g 硫酸亚铁 0.2g
牛肉浸出粉 5.0g 硫代硫酸钠 0.2g
乳糖 10.0g 0.2%酚磺酞指示液 12.5ml
蔗糖 10.0g 琼脂 12.0g
葡萄糖 1.0g 纯化水 1000ml
氯化钠 5.0g
除三种糖、0.2%酚磺酞指示液、琼脂外,取上述成分,混合,微温溶解, 调节pH 值使灭菌后在25℃的pH 值为7.3±0.1,加入琼脂,加热溶化后,再加入其余各成分,摇匀,分装,灭菌,制成高底层(2~3cm)短斜面。
明胶胰酶水解物 20.0g 甘油 10mL
氯化镁 1.4g 琼脂 13.6g
硫酸钾 10.0g 溴化十六烷基三甲铵 0.3g
纯化水 1000mL
除琼脂外,取上述成分,混合,微温溶解,调节pH 使灭菌后在25℃的pH 值为7.4±0.2,加入琼脂,加热煮沸1 分钟,分装,灭菌。
14、甘露醇盐琼脂培养基
胰酪胨 5.0g 氯化钠 75.0g
动物组织胃蛋白酶水解物 5.0g 酚红 25mg
牛肉浸出粉 1.0g 琼脂 15.0g
D-甘露醇 10.0g 纯化水 1000mL
除甘露醇、酚红、琼脂外,取上述成分,混合,微温溶解,调节pH 值使灭菌后在25℃的pH 值为7.4±0.2,加热并振摇,加入甘露醇、酚红、琼脂,煮沸1 分钟,分装,灭菌。
15、梭菌增菌培养基培养基
胨 10.0g 盐酸半胱氨酸 0.5g
牛肉浸出粉 10.0g 乙酸钠 3.0g
酵母浸出粉 3.0g 氯化钠 5.0g
可溶性淀粉 1.0g 琼脂 0.5g
葡萄糖 5.0g 纯化水 1000mL
除葡萄糖外,取上述成分,混合,加热煮沸使溶解,并不断搅拌。如需要,调节pH 值使灭菌后在25℃的pH 值为6.8±0.2。加入葡萄糖,混匀,分装,灭菌。
16、哥伦比亚琼脂培养基
胰酪胨 10.0g 玉米淀粉 1.0g
肉胃蛋白酶消化物 5.0g 氯化钠 5.0g
心胰酶消化物 3.0g 琼脂 10.0~15.0g(依凝固力)
酵母浸出粉 5.0g 纯化水 1000mL
除琼脂外,取上述成分,混合,加热煮沸使溶解,并不断搅拌。如需要,调节pH 值使灭菌后在25℃的pH 值为7.3±0.2,加入琼脂,加热溶化,分装,灭菌。如有必要,灭菌后,冷至45~50℃加入相当于20mg 庆大霉素的无菌硫酸庆大霉素,混匀,倾注平皿。
17. 念珠菌显色培养基
胨 10.2g 琼脂 15g
氢罂素 0.5g 灭菌水 1000ml
色素 22.0g
除琼脂外,取上述成分,混合,微温溶解,调节pH 值使灭菌后在25℃的pH 值为6.3±0.2。滤过,加入琼脂,加热煮沸,不断搅拌至琼脂完全溶解,倾注平皿。
说明:
1.微生物限度检查法收载于《中国药典》一、二、三部附录中,内容基本一致。
2.本稿是2010 年版微生物限度检查中“控制菌检查、培养基准备”的内容修订稿,参照ICH 协调案“非无菌产品微生物限度检查:控制菌检查法”进行修订。



















搜产品