1 范围
本标准规定了食品中弓形菌的检验方法。
本标准适用于食品中布氏弓形菌、嗜低温弓形菌和斯氏弓形菌的检验。
2 规范性引用文件
下列文件对于本文件的应用是必不可少的。凡是注日期的应用文件,仅注日期的版本适用于本文件,凡是不注日期的引用文件,其最新版本(包括所有的修改单)适用于本文件。
GB/T 6682 分析实验室用水规格和试验方法
GB 19489 实验室 生物安全通用标准
GB/T 27403 实验室质量控制规范 食品分子生物学检测
GB/T 27405 实验室质量控制规范 食品微生物检测
3 术语和定义
下列术语和定义适用于本文件。
3.1
弓形菌
弓形菌,为变形菌门Σ-变形菌纲弯曲菌目弯曲菌科的一个新属。呈弯曲或螺旋形杆状,不产芽孢,最佳生长氧气浓度为微量氧气(3%-10%),正常大气氧浓度条件下也可生长的革兰氏阴性细菌。
4 生物安全措施
为了保护实验室人员的安全,应由具备资格的工作人员检测弓形菌,所有培养物和废弃物应参照GB 19489、GB/T 27403和GB/T27405中的有关规定执行。
5 设备和材料
除微生物实验室常规灭菌与培养设备外,其他设备与材料如下:
5.1 冰箱:2℃-8℃。
5.2 恒温培养箱:25℃±1℃,30℃±1℃,36℃±1℃。
5.3 水浴或其他恒温装置:30℃±1℃,98℃。
5.4 微需氧培养装置:提供微需氧条件(5%氧气、10%二氧化碳和85%氮气)。
5.5 电子天平:感量0.1g。
5.6 均质器。
5.7 过滤装置及滤膜(0.22μm,0.45μm)。
5.8 显微镜:10×~100×,有相差功能。
5.9 离心机:离心机大于等于20000g。
5.10 核酸蛋白分析仪。
5.11 基因扩增仪。
5.12 电泳仪。
5.13 凝胶成像分析系统。
6 培养基和试剂
除有特殊说明外,所有试验用试剂均为分析纯,实验用水应符合GB/T 6682中一级水的要求。
6.1 JM肉汤
6.2 JM琼脂
6.3 弓形菌琼脂
6.4 布氏肉汤
6.5 布氏琼脂
6.6 氧化酶试剂
6.7 三糖铁琼脂
6.8 Hugh-Leifson培养基
6.9 马尿酸钠水解试剂
6.10 吲哚乙酸纸片
6.11 Mueller Hinton血琼脂
6.12 1mol/L,Tris-HCL缓冲液(pH8.0):称取121.1gTris,溶于800ml水中,搅拌,加入浓盐酸42ml,冷却至室温,用稀盐酸准确调整pH至8.0,分装后高压灭菌备用。
6.13 0.5mol/L EDTA(pH8.0):在800ml水中加入186.1gNa-EDTA*2H2O,在磁力搅拌器剧烈搅拌,用氢氧化钠调节浓度pH值至8.0(约20g氢氧化钠颗粒),然后定容至1L,分装后高压灭菌备用。
6.14 DNA提取液:量取100ml1mol/L Tris-HCL,50ml0.5mol/LEDTA,称取5.0gSDS,16.848g氯化钠,定容至1L,分装后高压灭菌备用。
6.15 引物:见表1.

6.16 Taq乘合酶。
6.17 dNTP:dATP,dTTP,dCTP,dGTP。
6.18 10×PCR缓冲液:100 mmol/L氯化钾,160 mmol/L硫酸铁,20 mmol/L硫酸镁.200 mmol/LTris-Hα(pH8.8),1 % TritonX-100, 1 mg/mL BSA。
6.19 DNA Marker。
6.20 质控参考菌株:布氏弓形菌ATCC 49616、嗜低温弓形茵ATCC 43158和斯氏弓形菌ATCC51332(或共他可溯源的菌株)。
6.21 10×上样缓冲液:0.25%溴酚蓝,40%蔗糖。
6.22 琼脂糖:电泳级。
6.23 溴化乙锭:10 mg/mL。
6.24 50×TAE电泳储备液:称取484 g Tris,量取114.2mL乙酸,200 mL 0.5mol/LEDTA(pH8.0),溶于蒸馏水中,定容至2 L。分装后高压灭菌备用。
第一法 常规检测方法
7 检验程序
见图1。
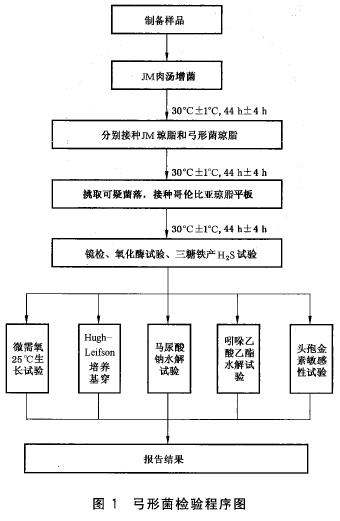
8.1 样品处理
8.1.1 一般样品
取25 g(或25 mL)样品加入盛有225 mL JM肉汤的有滤网的均质袋中(无滤网的均质袋可使用无菌纱布过滤),用拍击式均质器均质1 min-2 min;或加入盛有225 mL JM肉汤的均质杯中.以8 000r/min-10 000 r/min均质1min-2 min,经滤网或克菌纱布过。.将滤液进行培养。
8.1.2整禽等样品
用200 mL0.1%的蛋白胨水充分冲洗样品的内外部,并振荡2min-3min,经无菌纱布过滤至250 mL离心管中,16 000 g离心15 min后弃去上清,用10 mL0.1%蛋白胨水悬浮沉淀,吸取3mL于100 mL JM肉汤中。
8.1.3 需表面涂拭检测的样品
无菌棉签涂布样品表面(面积为50 cm2-100 cm2).将棉签头剪落到100 mL JM肉汤中进行培养。
8.1.4 水样
将4L的水(对于氯处理的水过滤前每升水中加人5 mL 1mol/L硫代硫酸钠溶液)经0.45μm.滤膜过滤,将滤膜浸没在100 mL JM肉汤中进行培养。
8.2 增菌
30℃土1℃培养44 h士4 h。必要时测定增菌液的pH值并调整至7.2士0.2。
8.3 分离
增菌液划线接种于JM琼脂与弓形茵掠脂平板上,30℃士1℃培养24 h-48 ho观察24 h培养与48 h培养的琼脂平板上的菌落形态。弓形菌在JM琼脂平板上形成灰色至白色、有或无红色晕轮、圆形、宜径约为1 mm-2 mm的菌落;弓形菌在弓形菌琼脂上形成半透明、浅黄色、光滑、圆形、宜径约为1 mm-2 mm的菌落。
8.4 弓形苗的形态和生化磐定
8.4.1 纯培养
挑取5个或更多的可疑菌落接种到布氏琼脂平板上,30℃±1℃培养24 h-48 h,按照8.4.1-8.4. 9进行鉴定,结果符合表2的可疑茵藩确认为弓形菌.必要时,还可参照附录B进行弓形菌属内种的鉴别。
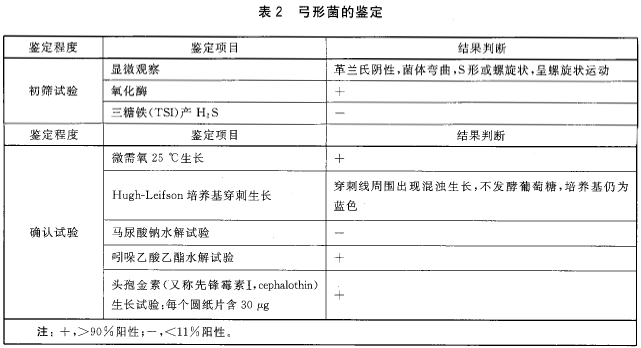
8.4.2 形态观囊
挑取可疑菌落进行革兰氏染色,镜检。
8.4.3 动力观察
挑取可疑茵落用1 mL布氏肉汤悬浮,用相羞显微镜观察运动状态.
8.4.4 氧化酶试验
用铂/铱接种环或玻璃棒挑取可疑菌落至氧化酶试剂润湿的滤纸上,如果在10 s内出现紫红色、紫罗兰或深蓝色为阳性。
8.4.5 微需氧条件下25℃生长斌验
挑取可疑菌落,接种到哥伦比亚血琼脂平板上,微需氧条件下25℃土1℃培养44 h土4 h,观察细菌生长情况。
8.4.6 三糖铁(TSI)生长试验
挑取可疑菌落,穿刺并划线接种到TSI高层斜面.30℃土1℃墙养24 h-48 h,观察细菌生长情况。弓形菌不产H2S,多数弓形菌产碱,底层和斜面均为红色。
8.4.7 Hugh-Leifson培养基穿刺生长
挑取可疑菌落,穿刺接种Hugh-Leifson培养基,30℃士1℃培养44h土4 h,弓形菌可在穿刺线周围出现混浊生长.不发酵葡萄塘,培养基仍为蓝色。
8.4.8 马尿酸钠水解试验
挑取菌落,加到盛有0.4 mL 1%马尿酸钠的试管中制成菌悬液。混合均匀后在36℃±1℃水浴放置2 h或36℃土1℃培养箱中放置4 h。沿着试臂壁缓缓加人0.2 mL茚三酮溶液,不要振荡,在36℃士1℃的水浴或培养箱中放宜10 min后判读结果。若出现深紫色则为阳性;出现淡紫色或没有颜色变化则为阴性。
8.4.9 吲哚乙酸酯水解试验
挑取菌落至吲哚乙酸酯纸片上,再滴加一滴灭菌水。如果吲哚乙酸酯水解,则在5 min-10min内出现深蓝色;若无颜色变化则没有发生水解。
8.4.10 药物敏感性试验(可选择)
挑取菌落,在布氏肉汤中制各成浓度为0.5 McFarland的菌悬液,在Mueller Hinton血琼脂平板上进行涂布.涂布时应从不同角度涂布.至少涂3次,静置5 min后去除多余液体,将平板在培养箱申放置10 min进行干燥。将头孢金素(30微克)药敏纸片放在琼脂表面。将平板里于微需氧条件下30℃士1℃培养44 h土4 h。如果细菌紧贴纸片生长则为有抗性,生长试验阳性;如果纸片周围出现不同程度的细菌抑制生长则为敏感.生长试验阴性。多致弓形茵30雌头袍金素生长试验阳性.但少数斯氏弓形菌生长试验阴性。
9 结果报告
综合上述检验结果.报告检样单位中检出或未检出弓形菌。
第二法 PCR法
10 检测步骤
10.1 样品处理、增菌和分离
样品处理、增菌和分离按第一法进行。
10.2 PCR模板的制备
取1 mL增菌肉汤至8000 r/min离心5 min,弃上清液,加人50μL DNA提取液.振荡混匀,98℃热处理5 min一10 min,12 000r/min离心5 min取上清液作为模板.可疑菌落则加入50μLDNA提取液,振荡混匀,98℃热处理5min-10min,12 000 r/min离心5 min取上猜液作为模版也可使用等效的商品化的DNA提取试剂盒并按其说明提取制备DNA模版。
10.3 所搜取DNA的质量评估
样品提取的DNA用核酸蛋自分析仪翻定,OD260与OD280的吸光比值介于1.7-2.0较好,符合PCR检测要求。
10.4 PCR检测
10.4.1 PCR反应体系
反应体系总体积50μL:5μL 10 X PCR缓冲液:1.5 mmol MgC12:引物各50 pmol;1.5 U Taq聚合酮;4种dNTP终浓度各0.2m mol/L;2μL模板。
10.4.2 PCR反应条件
pcR扩增的目的基因、扩堵片段长度、引物和PCR反应条件见表3。附录C还给出了各检测基因序列。

10.4.3 PCR质控对照
每次进行PCR检测均需要设置阳性对照、阴性对照和空白对照。其中,用布氏弓形菌、嗜低温弓形菌和斯氏弓形茵检测序列的DNA(或质粒)作为阳性对照.用非弓形茵的其他标谁茵株的DNA作阴性对照。用双蒸水替代模板作空白对照.
10.4.4 PCR扩增产物电泳
用电泳缓冲液(1×TAE)制各1.8%一2%琼脂糖凝胶(55℃一60℃时加入溴化乙锭至终浓度为0.5μg/mL,也可在电泳后进行染色)。取8μL-15μL PCR扩增产物,分别和2μL上样缓冲液混合,进行点样,用DNA分子量标记物做参照。3 V/cm-5 V/cn恒压电泳,电泳20 min-60 min,电泳检测结果用凝胶成像分析系统记录并保存。
10.4.5 PCR扩增结果判断
10.4.5.1 在阳性对照扩增出预期大小的条带、阴性对照和空白对照未扩增出目的条带的条件下,如样品PCR扩增出1202 bp条带,且同时扩增出2061 bp.198 bp或395 bp中的任何条带者(可为其中1-3条) ,即判断样品PCR产物为弓形菌阳性.其他情况判断样品PCR产物为弓形菌阴性。
10.4.5.2 如阳性对照末扩增出预期大小的条带,或阴性对照、空白对照扩增出目的条带时,本次检测结果无效,应重新做实验,以排除污染因素。
10.4.6 确认试验
对于PCR扩增为弓形菌阳性的样晶.用第一法进行确认。对于可疑纯菌落,也可用PCR法进行确认,必要时,还可对PCR扩增产物测序进一步确认。
11 结果报告
11.1 当增菌液PCR产物电泳检验结果为弓形菌阴性时.报告检验单位中未检出弓形茵。
11.2 当增菌液或可疑纯菌落的PCR产物电泳检验结果为弓形菌阳性时,根据确认试验结果,报告检验单位中检出或未检出弓形菌。



















搜产品